题目内容
某温度下,在500mL 0.01mol/L CH3COOH溶液中含CH3COOH、H+、CH3COO-共3.13×1021个,求该温度下,此溶液中CH3COOH的电离度.
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:某温度下,该溶液中n(醋酸)=0.5L×0.01mol/L=0.005mol,假设醋酸不电离,则醋酸分子个数为6.02×1023mol×0.005mol=3.01×1021,醋酸电离方程式为CH3COOH?H++CH3COO-,溶液中增加粒子的物质的量等于发生电离的醋酸的物质的量,再结合电离度公式计算.
解答:
解:某温度下,该溶液中n(醋酸)=0.5L×0.01mol/L=0.005mol,假设醋酸不电离,则醋酸分子个数为6.02×1023mol×0.005mol=3.01×1021,CH3COOH溶液中含CH3COOH、H+、CH3COO-共3.13×1021个,溶液中粒子增加个数=(3.13-3.01)×1021=0.12×1021,则增加粒子物质的量=
=1.99×10-4mol,根据CH3COOH?H++CH3COO-知,粒子增加的物质的量等于电离的醋酸的物质的量,所以发生电离的n(CH3COOH)=1.99×10-4mol,则电离度=
×100%=3.98%,
答:该温度下,溶液中CH3COOH的电离度为3.98%.
| 0.12×1021 |
| 6.02×1023/mol |
| 1.99×10-4mol |
| 0.005mol |
答:该温度下,溶液中CH3COOH的电离度为3.98%.
点评:本题考查了弱电解质的电离,明确溶液中增加粒子个数与发生电离醋酸分子之间的关系是解本题关键,题目难度不大.

练习册系列答案
相关题目
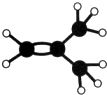 如图是某烃A分子的球棍模型.回答下列问题:
如图是某烃A分子的球棍模型.回答下列问题: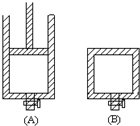 (1)用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/L H2SO4溶液来做中和热测定的实验,测得溶液在反应前后的温度变化为t1℃~t2℃(t2>t1),混合后溶液的比热容为c=4.18J/(g?℃),溶液的密度都近似为1g/mL,中和热△H=
(1)用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/L H2SO4溶液来做中和热测定的实验,测得溶液在反应前后的温度变化为t1℃~t2℃(t2>t1),混合后溶液的比热容为c=4.18J/(g?℃),溶液的密度都近似为1g/mL,中和热△H=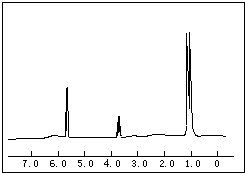 (1)将各有机物的序号填到对应分类中 ①CH3CH2CH3②CH2=CH-CH3③CH3COOCH3④H3C-OH⑤CH3CH2COOH 醇:
(1)将各有机物的序号填到对应分类中 ①CH3CH2CH3②CH2=CH-CH3③CH3COOCH3④H3C-OH⑤CH3CH2COOH 醇: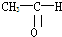 烯烃:
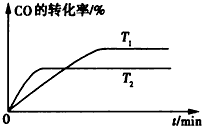
烯烃: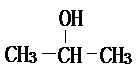 中的一种,根据图中信息,其结构简式为:
中的一种,根据图中信息,其结构简式为: