题目内容
1.将溶质的质量分数为a%的NaOH溶液蒸发掉m g水后,变成溶质的质量分数为2a%的NaOH不饱和溶液Vml,所得溶液的物质的量浓度为( )| A. | $\frac{ma}{V}$ mol/L | B. | $\frac{ma}{200V}$ mol/L | C. | $\frac{m}{2aV}$mol/L | D. | $\frac{ma}{2V}$ mol/L |
分析 根据溶质质量不变计算蒸发后溶液的质量,结合NaOH的质量分数计算NaOH的质量,根据n=$\frac{m}{M}$进而计算NaOH的物质的量,利用c=$\frac{n}{V}$计算蒸发后所得溶液的物质的量浓度.
解答 解:令蒸发后溶液的质量为xg,依据溶液蒸发浓缩前后溶质的质量不变,则:
(x+m)g×a%=xg×2a%,
解得x=m
NaOH的质量为mg×2a%=2am% g,物质的量为:$\frac{2am%g}{40g/mol}$=$\frac{am}{2000}$mol,蒸发后所得溶液体积为VL,所以蒸发后溶液的物质的量浓度为$\frac{\frac{am}{2000}}{V×10{\;}^{-3}L}$=$\frac{am}{2V}$mol/L,
故选:D.
点评 本题考查物质的量浓度计算、质量分数计算,明确计算公式,熟悉溶液蒸发浓缩过程中溶质的质量物质的量不变是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.下列分子的比例模型中,中心原子上存在孤电子对的是( )
| A. |  | B. |  | C. |  | D. |  |
1.室温下,下列有关电解质溶液的说法正确的是( )
| A. | 向0.1mol/L的醋酸溶液中加大量水稀释后溶液中$\frac{{c({H^+})}}{{c(C{H_3}CO{O^-})}}$不变 | |
| B. | 向0.1mol/L的醋酸溶液中加大量水稀释后溶液中$\frac{{c({H^+})}}{{c(C{H_3}CO{O^-})}}$变小 | |
| C. | 向蒸馏水中加入Na2O,水的电离程度变小 | |
| D. | 将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
9.下列有关物质的性质和该性质的应用均正确的是( )
| A. | NH3溶于水后显碱性,在FeCl3饱和溶液中通入足量NH3可制取Fe(OH)3胶体 | |
| B. | 碳酸钠溶液显碱性,用热的碳酸钠溶液可去除金属表面的油污 | |
| C. | 氢氟酸具有强酸性,可用于雕刻玻璃 | |
| D. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
16.在下列条件下,两种气体的分子数一定相等的是( )
| A. | 同密度、同压强的 N2 和 C2H4 | B. | 同体积、同密度的C2H4和CO | ||
| C. | 同温度、同体积的 O2和N2 | D. | 同压强、同体积的 O2和 N2 |
6.下列反应中,既能表现出硝酸的酸性,又能表现出其氧化性的是( )
| A. | 久置的浓硝酸显黄色 | |
| B. | 铜片放入硝酸中,溶液变蓝 | |
| C. | 碳单质放入浓硝酸中产生大量红棕色的气体 | |
| D. | 浓硝酸敞口放置在空气中,质量会减少 |
10.已知酸性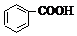 >H2CO3>
>H2CO3> >HCO3-,向Na2CO3溶液中逐滴加入水杨酸(
>HCO3-,向Na2CO3溶液中逐滴加入水杨酸( )溶液,可能发生的反应的离子方程式书写正确的是( )
)溶液,可能发生的反应的离子方程式书写正确的是( )
 >H2CO3>
>H2CO3> >HCO3-,向Na2CO3溶液中逐滴加入水杨酸(
>HCO3-,向Na2CO3溶液中逐滴加入水杨酸( )溶液,可能发生的反应的离子方程式书写正确的是( )
)溶液,可能发生的反应的离子方程式书写正确的是( )| A. | 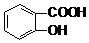 +CO32-→ +CO32-→ +HCO3- +HCO3- | B. |  +CO32-→ +CO32-→ +H2O+CO2↑ +H2O+CO2↑ | ||
| C. | 2 +CO32-→2 +CO32-→2 +CO2↑ +CO2↑ | D. | 3 +2CO32-→3 +2CO32-→3 +HCO3-+H2O+CO2↑ +HCO3-+H2O+CO2↑ |
11.某溶液中放入铝片可产生氢气,则在该溶液中一定能大量共存的一组离子是( )
| A. | Na+、Cl-、K+、SO42- | B. | Fe3+、Al3+、SO42-、NH4+ | ||
| C. | NH4+、SO42-、Mg2+、Cl- | D. | S2-、Na+、HCO3-、K+ |



