题目内容
3.下列有关化学用语正确的是( )| A. | 聚丙烯的结构简式: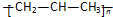 | B. | 二氧化碳的电子式: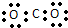 | ||
| C. | 中子数为18的硫原子:${\;}_{16}^{34}$S | D. | 乙醇的分子式:CH3CH2OH |
分析 A.聚丙烯是由丙烯不饱和的碳原子相互加成得到的,链节的主链上含有2个C;
B.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子;
C.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
D.CH3CH2OH为结构简式,不是分子式.
解答 解:A.聚丙烯是由丙烯不饱和的碳原子相互加成得到的,其结构简式为 ,故A错误;
,故A错误;
B.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,则其正确的电子式为 ,故B错误;
,故B错误;
C.S原子的质子数为16,中子数为18的硫原子的质量数为34,其表示方法为:${\;}_{16}^{34}$S,故C正确;
D.乙醇分子中含有2个C、6个H和1个O,其分子式为:C2H6O,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、结构简式、元素符号、分子式等知识,明确常见化学用语的表示方法为解答关键,试题培养了学生的分析能力及规范答题能力.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
13.某无色、澄清溶液中可能含有①Na+、②SO42-、③Cl-、④HCO3-、⑤CO32-、⑥H+、⑦Cu2+中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如表.下列结论正确的是( )
| 步骤 | 操作 | 现象 |
| (1) | 用紫色石蕊试液检验 | 溶液变红 |
| (2) | 向溶液中滴加BaCl2和稀HCl | 有白色沉淀生成 |
| (3) | 将(2)中所得混合物过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀生成 |
| A. | 肯定含有的离子是②③⑥ | B. | 肯定没有的离子是④⑤ | ||
| C. | 可能含有的离子是①③ | D. | 可能含有的离子是① |
14.某电解池内盛有CuSO4溶液,插入两根电极,接通直流电源后,欲达到如下要求:①阳极质量不变 ②阴极质量增加 ③电解液pH减小,则应选用的电极是( )
| A. | 阴阳两极都是石墨 | B. | 铜作阳极,铁作阴极 | ||
| C. | 铁作阳极,铜作阴极 | D. | 铜作阳极,铂作阴极 |
11.下列说法中正确的是( )
| A. | 胶体区别于其他分散系的本质特征是丁达尔效应 | |
| B. | 将小烧杯中25mL蒸馏水加至沸腾,向沸水中逐滴加入5~6滴氯化铁饱和溶液,继续煮沸至溶液呈红褐色,停止加热,可以制取Fe(OH)3胶体 | |
| C. | 溶液中分散质可通过滤纸,胶体中分散质不能通过滤纸 | |
| D. | 往Fe(OH)3胶体中逐滴加入稀H2SO4溶液时,开始时会出现凝聚,再继续逐滴加到过量时,沉淀也不会消失 |
18.某学生对SO2与漂粉精的反应进行实验探究:
(1)向水中持续通入SO2,未观察到白雾.推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀.
①实验a目的是检验白雾中是否含有Cl2,排除Cl2干扰;
②由实验a、b不能判断白雾中含有HCl,理由是白雾中混有SO2,SO2可与酸化的AgNO3反应产生白色沉淀;
(2)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应.通过进一步实验确认了这种可能性,其实验方案是向漂粉精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色;
(3)将A瓶中混合物过滤、洗涤,得到沉淀X.
①向沉淀X中加入稀HCl,无明显变化.取上层清液,加入BaCl2溶液,产生白色沉淀.则沉淀X中含有的物质是CaSO4;
②用离子方程式解释现象ⅲ中黄绿色褪去的原因SO2+Cl2+2H2O=SO42-+2Cl-+4H+.
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
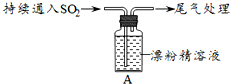 | i.液面上方出现白雾; ⅱ.稍后,出现浑浊,溶液变为黄绿色; ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀.
①实验a目的是检验白雾中是否含有Cl2,排除Cl2干扰;
②由实验a、b不能判断白雾中含有HCl,理由是白雾中混有SO2,SO2可与酸化的AgNO3反应产生白色沉淀;
(2)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应.通过进一步实验确认了这种可能性,其实验方案是向漂粉精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色;
(3)将A瓶中混合物过滤、洗涤,得到沉淀X.
①向沉淀X中加入稀HCl,无明显变化.取上层清液,加入BaCl2溶液,产生白色沉淀.则沉淀X中含有的物质是CaSO4;
②用离子方程式解释现象ⅲ中黄绿色褪去的原因SO2+Cl2+2H2O=SO42-+2Cl-+4H+.
8.常温下,以下各组离子在有关限定条件下溶液中一定能大量共存的是( )
| A. | 由水电离产生的c(H+)=10-12 mol/L的溶液中:K+、Na+、Fe2+、NO3- | |
| B. | 在c(H+)=$\sqrt{{K}_{W}}$mol/L的溶液中:K+、Fe3+、HCO3-、AlO2- | |
| C. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、SO42-、Cl- | |
| D. | pH=13的溶液中:NH4+、Na+、CO32-、SO42- |
15.某无色透明溶液可能含有下列离子中的几种:Mg2+、Fe3+、Ba2+、H+、SO42-、HCO3-、OH-,在其中加入金属铁,发生反应放出H2,试判断上述离子中一定不能大量存在于此溶液中的有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
12.下列离子方程式书写正确的是( )
| A. | 金属铝投入到氢氧化钠溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 三氯化铁溶液中加入铁粉 Fe3++Fe═2Fe2+ | |
| D. | 二氧化碳通入碳酸钠溶液中:CO2+CO32-+H2O═2HCO3- |
13.下列说法正确的是( )
| A. | 投入铁片产生H2的溶液中可大量存在H+、Mg2+、SO42-、NO3- | |
| B. | 将过量二氧化硫气体入冷氨水中:SO2+NH3•H2O═HSO3-+NH4+ | |
| C. | 1.0mol•L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO42- | |
| D. | 硫化铜溶于硝酸的离子方程式为CuS+2H+═H2S↑+Cu2+ |