题目内容
8.常温下,以下各组离子在有关限定条件下溶液中一定能大量共存的是( )| A. | 由水电离产生的c(H+)=10-12 mol/L的溶液中:K+、Na+、Fe2+、NO3- | |
| B. | 在c(H+)=$\sqrt{{K}_{W}}$mol/L的溶液中:K+、Fe3+、HCO3-、AlO2- | |
| C. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、SO42-、Cl- | |
| D. | pH=13的溶液中:NH4+、Na+、CO32-、SO42- |
分析 A.由水电离产生的c(H+)=10-12 mol/L的溶液,为酸或碱溶液;
B.在c(H+)=$\sqrt{{K}_{W}}$mol/L的溶液,显中性;
C.常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液,显碱性;
D.pH=13的溶液,显碱性.
解答 解:A.由水电离产生的c(H+)=10-12 mol/L的溶液,为酸或碱溶液,碱溶液中不能存在Fe2+,酸溶液中Fe2+、NO3-发生氧化还原反应,故A错误;
B.在c(H+)=$\sqrt{{K}_{W}}$mol/L的溶液,显中性,不能大量存在Fe3+,且Fe3+分别与HCO3-、AlO2-相互促进水解,AlO2-促进HCO3-的电离,不能共存,故B错误;
C.常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液,显碱性,该组离子之间不反应,可大量共存,故C正确;
D.pH=13的溶液,显碱性,不能大量存在NH4+,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
19.已知:相同的两种元素组成的四种微粒A、B、C、D的质子数依次增多,A、B、C、D的电子数如表(A、B、C、D有两组可能),且D中的电子数等于质子数,D1可作医用消毒液. 其中B1的沸点比B2高.
试回答下列问题:
(1)如表两组八种微粒的组成元素中,非金属性最强的元素在元素周期表的位置是第二周期第VI族;
(2)液态的B2与Na反应类似于B1与Na反应,写出液态的B2与Na反应的化学方程式:2Na+2NH3(l)=2NaNH2+H2↑.
(3)①亚氯酸钠(NaClO2)主要可用于棉纺、造纸业做漂白剂,也用于食品消毒、水处理等,制备亚氯酸钠,可以将ClO2气体通入D1和NaOH的混合液中,请写出制备化学反应方程式2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2,其中D1的作用是还原剂.
②利用①中原理制备出NaClO2•3H2O晶体的试样,可以用“间接碘量法”测定试样(不含能与Iˉ发生反应的氧化性杂质)的纯度,过程如图(已知:I2+2S2O32ˉ═S4O62ˉ+2Iˉ):
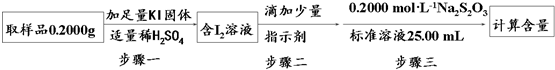
步骤一的离子方程式为ClO2-+4I-+4H+=2I2+Cl-+2H2O;步骤二的指示剂是淀粉;步骤三中出现溶液由蓝色变无色,且半分钟不变色现象时,达到滴定终点;计算该试样中NaClO2•3H2O的质量百分数为90.3%.(保留小数点后一位)
| ① | A1 | B1 | C1 | D1 |
| 电子数 | 10 | 10 | 10 | 18 |
| ② | A2 | B2 | C2 | D2 |
| 电子数 | 10 | 10 | 10 | 18 |
(1)如表两组八种微粒的组成元素中,非金属性最强的元素在元素周期表的位置是第二周期第VI族;
(2)液态的B2与Na反应类似于B1与Na反应,写出液态的B2与Na反应的化学方程式:2Na+2NH3(l)=2NaNH2+H2↑.
(3)①亚氯酸钠(NaClO2)主要可用于棉纺、造纸业做漂白剂,也用于食品消毒、水处理等,制备亚氯酸钠,可以将ClO2气体通入D1和NaOH的混合液中,请写出制备化学反应方程式2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2,其中D1的作用是还原剂.
②利用①中原理制备出NaClO2•3H2O晶体的试样,可以用“间接碘量法”测定试样(不含能与Iˉ发生反应的氧化性杂质)的纯度,过程如图(已知:I2+2S2O32ˉ═S4O62ˉ+2Iˉ):

步骤一的离子方程式为ClO2-+4I-+4H+=2I2+Cl-+2H2O;步骤二的指示剂是淀粉;步骤三中出现溶液由蓝色变无色,且半分钟不变色现象时,达到滴定终点;计算该试样中NaClO2•3H2O的质量百分数为90.3%.(保留小数点后一位)
16.下列溶液中H+浓度为0.1mol•L-1的是( )
| A. | 0.1 mol•L-1的CH3COOH | B. | 0.1 mol•L-1的NaHSO4 | ||
| C. | 0.1 mol•L-1的NaHCO3 | D. | 0.05 mol•L-1的H2SO3 |
3.下列有关化学用语正确的是( )
| A. | 聚丙烯的结构简式: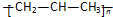 | B. | 二氧化碳的电子式: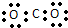 | ||
| C. | 中子数为18的硫原子:${\;}_{16}^{34}$S | D. | 乙醇的分子式:CH3CH2OH |
13.下列现象或应用不能用胶体知识解释的是( )
| A. | 肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 | |
| B. | 土壤表面积巨大且一般带负电,能吸收NH4+等营养离子,使土壤具有保肥能力 | |
| C. | 水泥、冶金厂常用高压电除去工厂烟尘,减少对空气的污染 | |
| D. | 氯化铝溶液中加入小苏打溶液会产生白色沉淀和气体 |
18.在无色透明强酸性溶液中,以下能大量共存的离子组是( )
| A. | K+、Cu2+、NO3-、CO32- | B. | Mg2+、Na+、Cl-、SO42- | ||
| C. | Mg2+、NH4+、NO3-、CO32- | D. | NH4+、K+、OH-、SO42- |
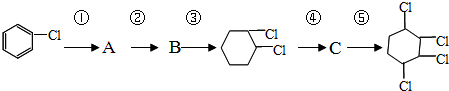
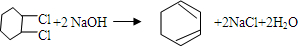 、⑤
、⑤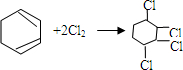 .
.