题目内容
17.几种短周期元素的原子半径及其某些化合价见下表:| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | +4、-2 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.102 | 0.110 | 0.143 | 0.160 | 0.186 |
(1)E元素在周期表中位于第三周期VIA族.
(2)A、H、J对应离子的半径由大到小的顺序是(填离子符号)F->Na+>Al3+,A离子的结构示意图为
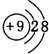 .
.(3)上述元素的最高价氧化物对应水化物的酸性最强的为S,碱性最强的为Na(填元素符号);这两种元素形成化合物的电子式为
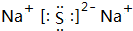 .
.
分析 短周期元素中,B、E均有-2价,处于ⅥA族,且原子半径E>D,则D为O、E为S;A有-1价,原子半径小于O,且与O原子半径相差不大,则A为F元素;D有+4、-4价,处于IV族,原子半径大于氧,且与氧原子半径相近,故D为碳元素;G有+5、-3价,原子半径大于S,故G为P;J、I、H化合价分别为+1、+2、+3,分别处于ⅠA族、ⅡA族、ⅢA族,原子半径J>I>H,且大于P原子半径,故J为Na、I为Mg、H为Al,据此解答.
解答 解:短周期元素中,B、E均有-2价,处于ⅥA族,且原子半径E>D,则D为O、E为S;A有-1价,原子半径小于O,且与O原子半径相差不大,则A为F元素;D有+4、-4价,处于IV族,原子半径大于氧,且与氧原子半径相近,故D为碳元素;G有+5、-3价,原子半径大于S,故G为P;J、I、H化合价分别为+1、+2、+3,分别处于ⅠA族、ⅡA族、ⅢA族,原子半径J>I>H,且大于P原子半径,故J为Na、I为Mg、H为Al.
(1)E为S元素,处于第三周期VIA族,故答案为:三;VIA;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:F->Na+>Al3+,F-离子结构示意图为 ,
,
故答案为:F->Na+>Al3+; ;
;
(3)上述元素的最高价氧化物对应水化物的酸性最强的为硫酸,碱性最强的为NaOH,这两种元素形成化合物为Na2S,电子式为 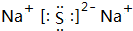 ,
,
故答案为:S;Na;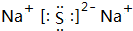 .
.
点评 本题考查结构性质位置关系应用,关键是根据化合价与原子半径推断元素,注意对元素周期律的理解掌握.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
12.自来水厂常用氯气给自来水消毒,某学生用自来水配制下列物质的溶液,不会产生明显药品变质的是( )
| A. | 亚硫酸钠 | B. | 硝酸银 | C. | 碳酸钠 | D. | 氯化铝 |
6.下列变化需要加入适当的氧化剂才能实现的是( )
| A. | CuO→Cu | B. | Fe→Fe2+ | C. | H2SO4→SO2 | D. | H2O2→O2 |
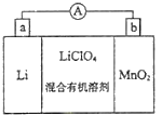 如图是锂锰电池的反应原理示意图,其中电解质KClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,得到LiMnO2.回答下列问题:
如图是锂锰电池的反应原理示意图,其中电解质KClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,得到LiMnO2.回答下列问题:
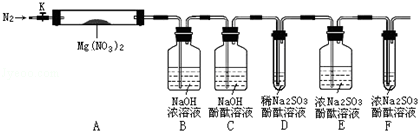
 ,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.
,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.