题目内容
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、常温常压下,11.2L氧气所含的原子数为NA |
| B、1.8g的NH4+离子中含有的电子数为10NA |
| C、常温常压下,48g O3含有的氧原子数为3NA |
| D、2.4 g金属镁变为镁离子时失去的电子数为0.1NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、气体摩尔体积vm=22.4L/mol使用条件是标准状况(0°C,101kPa);
B、先求出NH4+数目,电子的数目是NH4+数目的10倍,
C、根据n
=计算n(O),利用N(O)=n(O)?NA求算判断;
D、先求出镁原子数目,由于一个镁原子失去2e-变为镁离子,失去电子数是镁原子数目2倍.
B、先求出NH4+数目,电子的数目是NH4+数目的10倍,
C、根据n
| m |
| M |
D、先求出镁原子数目,由于一个镁原子失去2e-变为镁离子,失去电子数是镁原子数目2倍.
解答:
解:A、不是标准状况,不能使用气体摩尔体积vm=22.4L/mol,11.2L氧气的物质的量不是0.5mol,所含的原子数不是NA,故A错误;
B、1.8g的NH4+含有的NH4+数目为N(NH4+)=
×NA/mol=0.1NA,电子的数目为10×0.1NA=NA,故B错误;
C、n(O)=
=3mol,48gO3含有的氧原子数为N(O)=n(O)?NA=3mol×NAmol-1=3NA,故C正确;
D、2.4g金属镁含有镁原子数目N(Mg)=
NA/mol=0.1NA,失去电子数为2×0.1NA=0.2NA,故D错误.
故选C.
B、1.8g的NH4+含有的NH4+数目为N(NH4+)=
| 1.8g |
| 18g/mol |
C、n(O)=
| 48g |
| 16g/mol |
D、2.4g金属镁含有镁原子数目N(Mg)=
| 2.4g |
| 24g/mol |
故选C.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大

练习册系列答案
相关题目
 如图为可逆反应:A(s)+D(g)?E(g);△H<0的逆反应速率随时间变化情况,试根据图中曲线判断下列说法中不正确的是( )
如图为可逆反应:A(s)+D(g)?E(g);△H<0的逆反应速率随时间变化情况,试根据图中曲线判断下列说法中不正确的是( )| A、t3时刻可能采取的措施是减小c(D) |
| B、t5时刻可能采取的措施是降温 |
| C、t7时刻可能采取的措施是减小压强 |
| D、t5~t6时间段平衡向逆反应方向移动 |
某温度下,V mL不饱和NaNO3溶液a g,蒸发掉b g水或加入b g NaNO3固体(恢复到原温度)均可使溶液达到饱和,则下列量的计算结果正确的是( )
| A、该温度下NaNO3的溶解度为200 g | ||
B、原不饱和溶液中NaNO3的质量分数为
| ||
C、原不饱和溶液中NaNO3的物质的量浓度为
| ||
D、原不饱和溶液的密度为
|
下列措施对水的电离无影响的是( )
| A、升高温度 | B、加入稀醋酸 |
| C、加入醋酸钠 | D、加入食盐 |
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示,下列叙述中正确的是( )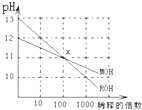

| A、MOH和ROH都是强碱 |
| B、在x点,c(M+)=c(R+) |
| C、稀释前,c(ROH)=10c(MOH) |
| D、常温下,pH之和为14的醋酸和ROH溶液等体积混合,所得溶液呈酸性 |
下列离子方程式正确的是( )
| A、石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | ||||
B、向沸水中滴加饱和的FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O(沸水)
| ||||
| C、氢氧化铜与稀硫酸反应:H++OH-═H2O | ||||
| D、碳酸氢钠溶液中加入盐酸:CO32-+2H+═CO2↑+H2O |
以锌片和铜片为两级,以稀硫酸为电解质溶液组成原电池,当导线中通过2mol电子时,下列说法正确的是( )
| A、锌片溶解了1mol电子时,铜片上析出了1mol H2 |
| B、两级上溶解和析出的物质的量相等 |
| C、锌片溶解了31g,铜片上析出了1g H2 |
| D、锌片溶解了1mol,硫酸消耗了1mol |
 我国支持“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是
我国支持“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是