题目内容
(1)请写出F-的结构示意图 ;37Cl和35Cl互为 .
(2)3.01×1024个OH-与 molNH3的质量相同.
(3)15.6g Na2X中含Na+ 0.4mol,则X的相对原子质量是 .
(4)3.6g重水2H2O含电子物质的量为 .
(5)在一定温度和压强下,3L气体A2跟9L体积的气体B2完全化合生成6L体积某气体C,则该气体C的化学式为(用A、B表示) .
(2)3.01×1024个OH-与
(3)15.6g Na2X中含Na+ 0.4mol,则X的相对原子质量是
(4)3.6g重水2H2O含电子物质的量为
(5)在一定温度和压强下,3L气体A2跟9L体积的气体B2完全化合生成6L体积某气体C,则该气体C的化学式为(用A、B表示)
考点:阿伏加德罗定律及推论
专题:阿伏加德罗常数和阿伏加德罗定律
分析:(1)氟离子的核电荷数为9,核外电子总数为10,最外层达到8电子稳定结构;同种元素的不同原子互为同位素;
(2)氢氧根离子与氨气的摩尔质量都是17g/mol,根据m=nM可知,二者的物质的量相等,则二者的质量相同;
(3)根据该化合物的化学式计算出化合物的物质的量,再根据M=
计算出化合物的摩尔质量,最后计算出X的相对原子质量;
(4)2H2O中含有10个电子,摩尔质量为20g/mol,先计算重水的物质的量,再结合每个重水分子中含有电子数计算;
(5)同一条件下,参加反应的气体的体积之比等于其计量数之比,再结合原子是判断C的化学式.
(2)氢氧根离子与氨气的摩尔质量都是17g/mol,根据m=nM可知,二者的物质的量相等,则二者的质量相同;
(3)根据该化合物的化学式计算出化合物的物质的量,再根据M=
| m |
| n |
(4)2H2O中含有10个电子,摩尔质量为20g/mol,先计算重水的物质的量,再结合每个重水分子中含有电子数计算;
(5)同一条件下,参加反应的气体的体积之比等于其计量数之比,再结合原子是判断C的化学式.
解答:
解:(1)氟离子的核电荷数为9,核外电子数为10,氟离子的离子结构示意图为: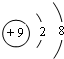 ,
,
37Cl和35Cl质子数都是17,中子数分别为20、18.所以二者质子数相同、中子数不同,所以二者互为同位素,
故答案为: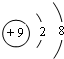 ;同位素
;同位素
(2)3.01×1024个OH-的物质的量为:n(OH-)=
=5mol,氢氧根离子与氨气的摩尔质量都是17g/mol,二者的物质的量相同时具有相同的质量,所以氨气的物质的量为5mol,
故答案为:5;
(3)15.6g Na2X中含Na+ 0.4mol,则该化合物的物质的量为:0.4mol×
=0.2mol,该化合物的摩尔质量为:
=78g/mol,则X的相对原子质量为:78-23×2=32,
故答案为:32;
(4)3.6g重水2H2O的物质的量为:
=0.18mol,0.18mol该水分子中含有的电子的物质的量为:0.18mol×10=1.8mol,故答案为:1.8mol;
(5)同一条件下,参加反应的气体的体积之比等于其计量数之比,则A2、B2、C的计量数之比=3L:9L:6L=1:3:2,该方程式为:A2+3B2=2C,根据原子守恒知,C的化学式为AB3或B3A,故答案为:AB3或B3A.
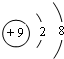 ,
,37Cl和35Cl质子数都是17,中子数分别为20、18.所以二者质子数相同、中子数不同,所以二者互为同位素,
故答案为:
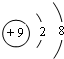 ;同位素
;同位素(2)3.01×1024个OH-的物质的量为:n(OH-)=
| 3.01×1024 |
| 6.02×1023 |
故答案为:5;
(3)15.6g Na2X中含Na+ 0.4mol,则该化合物的物质的量为:0.4mol×
| 1 |
| 2 |
| 15.6g |
| 0.2mol |
故答案为:32;
(4)3.6g重水2H2O的物质的量为:
| 3.6g |
| 20g/mol |
(5)同一条件下,参加反应的气体的体积之比等于其计量数之比,则A2、B2、C的计量数之比=3L:9L:6L=1:3:2,该方程式为:A2+3B2=2C,根据原子守恒知,C的化学式为AB3或B3A,故答案为:AB3或B3A.
点评:本题考查了物质的量的综合计算,题目难度中等,试题知识点较多、综合性较强,熟练基本公式是解本题关键,注意重水的摩尔质量是20g/mol而不是18g/mol,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.0molPCl5充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl5(g)?PCl3(g)+Cl2(g)达平衡时,PCl3(g) 为0.4mol,如果此时再加入1.0molPCl5(g),在相同条件下再达到平衡时,下列说法正确的是( )
| A、PCl5为0.6mol |
| B、PCl3大于0.8mol |
| C、再次达平衡时PCl5的体积分数比原平衡减小 |
| D、再次达平衡时PCl5的转化率比原平衡减小 |
恒温条件下,把NO2装入带活塞的密闭容器中,当反应2NO2?N2O4达到平衡后,慢慢压缩,下列叙述正确的是( )
| A、体积减半,则压强为原来的两倍 |
| B、平衡向右移动,混合气体的颜色一定会变浅 |
| C、体积减半,压强增大,但小于原来的2倍 |
| D、平衡向右移动,混合气体密度增大 |
如图表示汽车尾气净化处理示意图:有关叙述正确的是( )
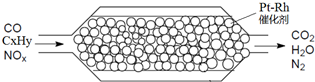

| A、NOX全部被过量CO还原为N2 |
| B、安装有该净化器的汽车可以使用含铅汽油 |
| C、催化剂涂在蜂窝状陶瓷上,可以提高反应速率 |
| D、当产生2.24L氮气时,转移的电子为4xmol |
将一定量的锌与100mL 18.5mol?L-1浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6L(标准状况).将反应后的溶液稀释至1L,则得溶液中c(H+)=0.1mol?L-1,则下列叙述中错误的是( )
| A、气体A为SO2和H2的混合物 |
| B、气体A中SO2和H2的体积比为1:5 |
| C、反应中消耗的Zn的质量为97.5 g |
| D、反应中共转移电子3 mol |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、常温常压下,11.2L氧气所含的原子数为NA |
| B、1.8g的NH4+离子中含有的电子数为10NA |
| C、常温常压下,48g O3含有的氧原子数为3NA |
| D、2.4 g金属镁变为镁离子时失去的电子数为0.1NA |
设NA为阿伏加德罗常数的值,下列判断正确的是( )
| A、2gH2中含氢原子数为 NA |
| B、1L 1mol/L BaCl2溶液中含有的氯离子数为NA |
| C、标准状况下,22.4L H2O所含的原子数为3 NA |
| D、0.1mol铁粉在足量氯气中充分燃烧,转移的电子数为0.3NA |
下列说法正确的是( )
| A、15 g乙烷所含极性共价键的数目为3×6.02×1023 |
| B、标准状况下,11.2 L臭氧中含氧原子数为6.02×1023 |
| C、常温下,100 mL 0.1mol/L醋酸溶液中含醋酸分子为0.01×6.02×1023 |
| D、一定条件下,2 mol 二氧化硫和1 mol 氧气混合,反应时转移的电子数为4×6.02×1023 |