题目内容
17.把6mol A(g)和5mol B(g)混合后放入4L密闭容器中,在一定条件下发生反应,3A(气)+B(气)?2C(气)+xD(气),经过5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1 mol/(L•min),下列说法中错误的是( )| A. | A的平均反应速率为0.15mol/(L•min) | |
| B. | 恒温达平衡时,容器内压强为开始时的75% | |
| C. | B的转化率为20% | |
| D. | 平衡时A的浓度为0.75mol/L |
分析 A.5min达到平衡,生成C为2mol,则消耗n(A)=$\frac{3}{2}$n(C)=$\frac{3}{2}$×2mol=3mol,再根据v(A)=$\frac{\frac{△n(A)}{V}}{△t}$计算;
B.同一可逆反应同一时间段内各物质的反应速率之比等于其计量数之比,v(A):v(D)=0.15mol/(L•min):0.1 mol/(L•min)=3:2,所以x=2,反应前后气体物质的量之和不变,则反应前后气体压强不变;
C.5min达到平衡,生成C为2mol,则消耗n(B)=$\frac{1}{2}$n(C)=$\frac{1}{2}$×2mol=1mol,B的转化率=$\frac{参加反应的B物质的量}{B的初始物质的量}$×100%;
D.平衡时A的浓度=起始浓度-浓度变化量.
解答 解:A.5min达到平衡,生成C为2mol,则消耗n(A)=$\frac{3}{2}$n(C)=$\frac{3}{2}$×2mol=3mol,v(A)=$\frac{\frac{△n(A)}{V}}{△t}$=$\frac{\frac{3mol}{4L}}{5min}$=0.15mol/(L•min),故A正确;
B.同一可逆反应同一时间段内各物质的反应速率之比等于其计量数之比,v(A):v(D)=0.15mol/(L•min):0.1 mol/(L•min)=3:2,所以x=2,反应前后气体物质的量之和不变,则反应前后气体压强不变,故B错误;
C.5min达到平衡,生成C为2mol,则消耗n(B)=$\frac{1}{2}$n(C)=$\frac{1}{2}$×2mol=1mol,B的转化率=$\frac{参加反应的B物质的量}{B的初始物质的量}$×100%=$\frac{1mol}{5mol}×100%$=20%,故C正确;
D.平衡时A的浓度=$\frac{6mol}{4L}$-$\frac{3mol}{4L}$mol/L=0.75mol/L,故D正确;
故选B.
点评 本题考查化学平衡有关计算,涉及转化率、物质的量浓度、计量数、反应速率的计算,侧重考查分析计算能力,明确计量数与反应速率、物质的量浓度变化量等之间的关系是解本题关键,题目难度不大.

| A. | x=1 | |
| B. | B的转化率为20% | |
| C. | 反应的10s内A的反应速率为0.3mol•L-1•s-1 | |
| D. | 反应进行到10s时,在相同温度下容器内混合气体的压强是反应前的85% |
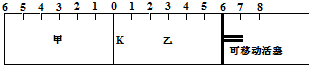
若平衡时K停留在0刻度左侧1处,则活塞停留在0刻度右侧( )
| A. | 右侧6处 | B. | 右侧6~7处 | C. | 右侧7处 | D. | 右侧7~8处 |
| A. | H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | CH3COOH溶液与NaOH溶液反应:H++OH-═H2O | |
| C. | 铁与稀硫酸反应:Fe+2H+═Fe2++H2↑ | |
| D. | 硫酸与Cu(OH)2反应:H++OH-═H2O |
 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.