题目内容
20.下列离子方程式中,错误的是( )| A. | 铜丝与硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| B. | 少量碳酸氢钠与氢氧化钙反应:HCO3-+OH-+Ca2+═CaCO3↓+H2O | |
| C. | 稀盐酸与氢氧化钠溶液混合:H++OH-═H2O | |
| D. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ |
分析 A.电荷不守恒;
B.少量碳酸氢钠与氢氧化钙反应生成碳酸钙、氢氧化钠和水;
C.二者反应生成氯化钠和水;
D.钠与水反应生成氢氧化钠和氢气.
解答 解:A.铜丝与硝酸银溶液反应:Cu+2Ag+═Cu2++2Ag,故A错误;
B.少量碳酸氢钠与氢氧化钙反应,离子方程式:HCO3-+OH-+Ca2+═CaCO3↓+H2O,故B正确;
C.稀盐酸与氢氧化钠溶液混合,离子方程式:H++OH-═H2O,故C正确;
D.钠与水反应,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故D正确;
故选:B.
点评 本题考查了离子方程式的书写,明确离子反应的实质及离子方程式书写方法是解题关键,题目难度不大.

练习册系列答案
相关题目
10.一定条件下合成乙烯6H2(g)+2CO2(g)$\stackrel{催化剂}{?}$ CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法错误的是( )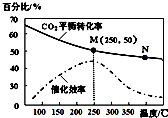

| A. | 生成乙烯的速率:v(M)有可能小于v(N) | |
| B. | 平衡常数:KM>KN | |
| C. | 催化剂可能会影响CO2的平衡转化率 | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7% |
11.图为一种天然产物,具有一定除草功效.下列有关该化合物的说法正确的是 ( )
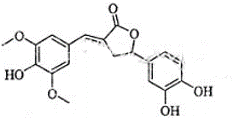

| A. | 分子中含有三种含氧官能团 | |
| B. | 1mol该化合物最多能与6molNaOH反应 | |
| C. | 既能与FeC13发生显色反应,也能和NaHCO3反应放出CO2 | |
| D. | 既可以发生取代反应,又能够发生加成反应. |
8.在密闭容器中充入CO2、CO、H2、C2H6的混合气体m g,若加入足量的Na2O2,充分振荡并不断用电火花引燃至反应完全,测得固体质量增重m g,则相同条件下,CO2与C2H6的体积比为( )
| A. | 4:1 | B. | 2:1 | ||
| C. | 1:1 | D. | 缺少条件,无法计算 |
15.2014年在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、高锰酸钾溶液、次氯酸钠溶液、双氧水等消毒剂可以完全灭活病毒感染性.下列有关说法正确的是( )
| A. | 高锰酸钾溶液和双氧水均可以将病毒氧化而达到消毒的目的 | |
| B. | 乙醇、次氯酸钠溶液的消毒原理相同 | |
| C. | 双氧水和次氯酸钠具有较强的腐蚀性,不能用于皮肤的消毒 | |
| D. | 在次氯酸钠溶液中通入少量二氧化硫可发生反应:2NaClO+SO2+H2O═Na2SO3+HClO |
5.若要在铁片上镀铜,下列叙述中正确的是( )
①将铁片接在电源的正极 ②将铜片接在电源的正极 ③在铁片上发生的反应是Cu2++2e-═Cu ④在铜片上发生的反应是4OH--4e-═2H2O+O2↑ ⑤可用含Fe2+的溶液作电镀液 ⑥可用含Cu2+的溶液作电镀液.
①将铁片接在电源的正极 ②将铜片接在电源的正极 ③在铁片上发生的反应是Cu2++2e-═Cu ④在铜片上发生的反应是4OH--4e-═2H2O+O2↑ ⑤可用含Fe2+的溶液作电镀液 ⑥可用含Cu2+的溶液作电镀液.
| A. | ①③⑥ | B. | ②③⑥ | C. | ①④⑤ | D. | ②③④ |
10.已知K2O2和Na2O2都是过氧化物,化学性质非常相似.下列含氧化合物中氧的化合价最低的是( )
| 选项 | 含氧化合物 |
| A | K2O2 |
| B | H2O2 |
| C | Na2CO3 |
| D | Na2O2 |
| A. | A | B. | B | C. | C | D. | D |