题目内容
3.下列关于各图象的解释或结论正确的是( )| A. |  热化学方程式是H2(g)+$\frac{1}{2}$O2(g)=H2O(g) DH=-241.8 kJ/mol | |
| B. | 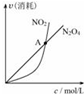 对于恒温恒容条件下的反应2NO2(g)?N2O4(g),A点为平衡状态 | |
| C. | 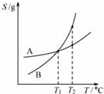 将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数B>A | |
| D. |  HA的酸性强于HB |
分析 A、图象中当放热483.6KJ时,是生成液态水的时候;
B、A点时,NO2和N2O4的消耗速率相等;
C、T1℃时,A和B的溶解度相同,溶质的质量分数相同;
D、加水稀释时,HA的pH变化大,故HA的酸性强于HB.
解答 解:A、图象中当放热483.6KJ时,是生成液态水的时候,故热化学方程式应是H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-241.8 kJ/mol,故A错误;
B、A点时,只说明NO2和N2O4的消耗速率相等,而当NO2和N2O4的消耗速率之比为2:1时,反应才达平衡,故B错误;
C、T1℃时,A和B的溶解度相同,饱和溶液中溶质的质量分数相同,当升温到T2℃时,两者的溶解度均变大,无晶体析出,故溶液中的溶质的质量分数均不变,仍相等,故C错误;
D、从图象可以看出,加水稀释时,HA的pH变化大,故HA的酸性强于HB,故D正确;
故选D.
点评 本题考查了图象的问题,应注意的是升高温度,A 和 B的溶解度均增大,无晶体析出,故溶质的质量分数不变.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
14.工业上用反应 3Cl2+2NH3=N2+6HCl 检查氯气管道是否漏气,下列说法正确的是( )
| A. | 该反应属于复分解反应 | B. | 该反应中Cl2是还原剂 | ||
| C. | 该反应中NH3发生还原反应 | D. | 该反应生成1molN2有6mol电子转移 |
11.图为一种天然产物,具有一定除草功效.下列有关该化合物的说法正确的是 ( )


| A. | 分子中含有三种含氧官能团 | |
| B. | 1mol该化合物最多能与6molNaOH反应 | |
| C. | 既能与FeC13发生显色反应,也能和NaHCO3反应放出CO2 | |
| D. | 既可以发生取代反应,又能够发生加成反应. |
8.在密闭容器中充入CO2、CO、H2、C2H6的混合气体m g,若加入足量的Na2O2,充分振荡并不断用电火花引燃至反应完全,测得固体质量增重m g,则相同条件下,CO2与C2H6的体积比为( )
| A. | 4:1 | B. | 2:1 | ||
| C. | 1:1 | D. | 缺少条件,无法计算 |
15.2014年在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、高锰酸钾溶液、次氯酸钠溶液、双氧水等消毒剂可以完全灭活病毒感染性.下列有关说法正确的是( )
| A. | 高锰酸钾溶液和双氧水均可以将病毒氧化而达到消毒的目的 | |
| B. | 乙醇、次氯酸钠溶液的消毒原理相同 | |
| C. | 双氧水和次氯酸钠具有较强的腐蚀性,不能用于皮肤的消毒 | |
| D. | 在次氯酸钠溶液中通入少量二氧化硫可发生反应:2NaClO+SO2+H2O═Na2SO3+HClO |