题目内容
15.下列实验设计及其对应的离子方程式均正确的是( )| A. | 用浓盐酸与铁屑反应制取H2:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| C. | 用醋酸除去水垢:CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ | |
| D. | 将氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-+ClO- |
分析 A.不符合反应客观事实,二者反应生成氯化亚铁和氢气;
B.高锰酸钾能够氧化浓盐酸中的氯离子;
C.醋酸与碳酸钙反应生成醋酸钙、二氧化碳和水;
D.次氯酸为弱酸,应保留化学式.
解答 解:A.用浓盐酸与铁屑反应制取H2,离子方程式:Fe+2H+═Fe2++H2↑,故A错误;
B.高锰酸钾能够氧化浓盐酸中的氯离子,对过氧化氢还原性检验造成干扰,故B错误;
C.醋酸与碳酸钙反应生成醋酸钙、二氧化碳和水,离子方程式:CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑,故C正确;
D.将氯气溶于水制备次氯酸,离子方程式:Cl2+H2O═H++HCl+ClO-,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意化学式拆分、注意离子反应遵循客观事实,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.常温下,不溶于浓H2SO4,也不溶于浓HNO3和浓NaOH溶液的金属是( )
| A. | 铁 | B. | 钠 | C. | 镁 | D. | 铜 |
6.90%的硫酸与10%的硫酸等体积混合,所得溶液的质量分数为( )
| A. | 等于50% | B. | 大于50% | C. | 小于50% | D. | 无法确定 |
3.下列实验现象可用同一原理解释的是( )
| A. | 品红溶液中分别通入SO2和Cl2,品红均褪色 | |
| B. | 鸡蛋白溶液中分别加入NaCl溶液和HgCl2溶液,均有固体析出 | |
| C. | 分别加热盛有NH4Cl和单质碘的试管,管口均有固体凝结 | |
| D. | 溴水分别滴入植物油和裂化汽油中,溴水均褪色 |
10.化合物X是一种医药中间体,其结构简式如图.下列有关物质X的说法不正确的是( )
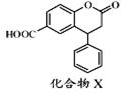

| A. | 可以与饱和Na2CO3溶液反应 | |
| B. | 分子中两个苯环一定处于同一平面 | |
| C. | 在酸性条件下水解,水解产物只有一种 | |
| D. | 1 mol化合物X最多能与3 mol NaOH反应 |
20.已知:25°C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11.则该温度下,下列说法正确的是
( )
( )
| A. | 在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 | |
| B. | 饱和Mg(OH)2溶液与饱和MgF2 溶液相比,前者的c(Mg2+)大 | |
| C. | Mg(OH)2固体在0.01mol/L氨水中的Ksp比在 0.01mol/L NH4Cl 溶液中的Ksp小 | |
| D. | 在Mg(OH)2的悬浊液加入NaF 溶液后,不可能有MgF2沉淀生成 |
4.设NA为阿伏加德罗常数,下列叙述错误的是( )
| A. | 标况下,4.48L氦气和重氢气的混合物中含中子数为0.4NA | |
| B. | 在含有4molSi-O键的石英晶体中,氧原子数目为2 NA | |
| C. | 7.8克过氧化钠中,所含阴、阳离子总数为0.4NA | |
| D. | 28克N60单质中(如图),含的N-N键(σ键)个数为3 NA |
5.化学与生产、生活密切相关.下列说法不正确的是( )
| A. | 煤的干馏、石油的裂解都是化学变化 | |
| B. | 用CO2合成聚碳酸酯等可降解塑料,减少白色污染 | |
| C. | 光化学烟雾、硝酸型酸雨的形成都与氮氧化合物有关 | |
| D. | 人造纤维、合成纤维和光导纤维都属于有机高分子化合物 |