题目内容
6.90%的硫酸与10%的硫酸等体积混合,所得溶液的质量分数为( )| A. | 等于50% | B. | 大于50% | C. | 小于50% | D. | 无法确定 |
分析 硫酸溶液的浓度越大,其密度就越大,混合后溶质质量为混合前两溶液中溶质质量之和,混合后溶液质量为混合前溶液质量之和,结合溶质质量分数=$\frac{溶质质量}{溶液质量}$×100%进行计算.
解答 解:假设硫酸的体积都为V,90%硫酸的密度为ρ1、10%硫酸的密度为ρ2,硫酸的浓度越大,密度就越大,则ρ1>ρ2;
混合后所得溶液的溶质质量分数=$\frac{ρ{\;}_{1}V×90%+ρ{\;}_{2}V×10%}{{ρ}_{1}V+ρ{\;}_{2}V}$=$\frac{{ρ}_{1}×90%+{ρ}_{2}×10%}{{ρ}_{1}+{ρ}_{2}}$,
若ρ1=ρ2,混合后所得溶液的溶质质量分数等于50%,
由于ρ1>ρ2,故混合后所得溶液的溶质质量分数大于50%.
故选B.
点评 本题考查溶液中溶质质量分数及相关计算,题目难度不大,注意密度比水大的两种不同浓度溶液混合,等体积混合后所得溶液中溶质的质量分数大于等质量混合后所得溶液中溶质的质量分数,密度比水小的两种不同浓度溶液混合,等体积混合后所得溶液中溶质的质量分数小于等质量混合后所得溶液中溶质的质量分数.

练习册系列答案
相关题目
1.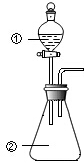 用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
 用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( ) | 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 浓盐酸 | MnO2 | 产生黄绿色气体 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 酸化的FeCl2溶液 | H2O2溶液 | 溶液变成黄棕色,有气泡产生 |
| D | Fe2(SO4)3溶液 | 铜粉 | 溶液变蓝色,有黑色固体产生 |
| A. | A | B. | B | C. | C | D. | D |
14.常温下能发生反应的一组气体是( )
| A. | N2、O2 | B. | NO、O2 | C. | H2、O2 | D. | H2、CO |
1.下列说法中正确的是( )
| A. | 1 mol•L-1的NaCl溶液是指由1 mol NaCl和1 000 mL水配制成的溶液 | |
| B. | 从1 L 0.5 mol•L-1的NaCl溶液中取出100 mL,剩余溶液物质的量浓度为0.45 mol•L-1 | |
| C. | 0℃时,2 mol Cl2的体积可能为22.4 L | |
| D. | CaCl2的摩尔质量是111 g |
11. 如表是实验室制备气体的有关内容:
如表是实验室制备气体的有关内容:
(1)上述实验原理中,从反应中有无电子转移的角度看,明显不同于其他气体的是② (填编号),写出实验室常用的制取该气体的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)根据表中所列实验原理,从下列装置中选择合适的发生装置,将其字母填入上表的空格中.
(3)若用上述制备O2的装置制备NH3,应选择的试剂为浓氨水和氢氧化钠(或生石灰等)
(4)在浓CaCl2溶液中通入NH3和CO2可以制得碳酸钙,制取时应先通入的气体是NH3,该反应的化学方程式为:CaCl2+CO2+2NH3+H2O=CaCO3+2NH4Cl.
(5)制备8mol•L-1的盐酸100mL,现用12mol•L-1的盐酸来配制.①需要用量筒量取12mol•L-1的盐酸的体积为66.7mL;
②实验室提供有如下仪器,为完成配制需要选择的仪器为ACFGH
A.100mL量筒
B.托盘天平
C.玻璃棒
D.50mL容量瓶
E.10mL量筒
F.胶头滴管
G.100mL烧杯
H.100mL容量瓶
③下列实验操作中不正确的是BC (填写字母).
A.使用容量瓶前,检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,用量筒量取浓盐酸并沿玻璃棒倒入容量瓶中,缓慢加入蒸馏水到距离刻度线1~2cm处,改用胶头滴管滴加蒸馏水直到凹液面的最低点和刻度线相平
D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次.
 如表是实验室制备气体的有关内容:
如表是实验室制备气体的有关内容:| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2-→O2 | |
| ② | 制氨气 | NH4Cl-→NH3 | |
| ③ | 制氯气 | HCl-→Cl2 |
(2)根据表中所列实验原理,从下列装置中选择合适的发生装置,将其字母填入上表的空格中.
(3)若用上述制备O2的装置制备NH3,应选择的试剂为浓氨水和氢氧化钠(或生石灰等)
(4)在浓CaCl2溶液中通入NH3和CO2可以制得碳酸钙,制取时应先通入的气体是NH3,该反应的化学方程式为:CaCl2+CO2+2NH3+H2O=CaCO3+2NH4Cl.
(5)制备8mol•L-1的盐酸100mL,现用12mol•L-1的盐酸来配制.①需要用量筒量取12mol•L-1的盐酸的体积为66.7mL;
②实验室提供有如下仪器,为完成配制需要选择的仪器为ACFGH
A.100mL量筒
B.托盘天平
C.玻璃棒
D.50mL容量瓶
E.10mL量筒
F.胶头滴管
G.100mL烧杯
H.100mL容量瓶
③下列实验操作中不正确的是BC (填写字母).
A.使用容量瓶前,检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,用量筒量取浓盐酸并沿玻璃棒倒入容量瓶中,缓慢加入蒸馏水到距离刻度线1~2cm处,改用胶头滴管滴加蒸馏水直到凹液面的最低点和刻度线相平
D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次.
18.在 700℃时,向容积为 2L 的密闭容器中充入一定量的 CO 和 H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中 t2>t1).
下列说法中正确的是( )
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.20 | |
| t2 | 0.80 |
| A. | 反应在 t1min 内的平均反应速率为υ(CO2)=0.40/t1mol/(L•min) | |
| B. | 到 t1min 时,反应未达到平衡状态 | |
| C. | 温度升至 800℃时,上述反应的平衡常数为 0.64,则正反应为放热反应 | |
| D. | 保持 700℃不变,向平衡体系中再通入 0.60 mol CO 和 0.30 mol H2O,达到新的平衡,与原平衡相比,CO的转化率增大,H2的体积分数增大 |
15.下列实验设计及其对应的离子方程式均正确的是( )
| A. | 用浓盐酸与铁屑反应制取H2:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| C. | 用醋酸除去水垢:CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ | |
| D. | 将氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-+ClO- |