题目内容
合成氨是人类科学技术上的一项重大突破.
(1)NH3经一系列反应可以得到HNO3和NH4NO3.(如图1)Ⅱ中,2NO(g)+O2(g)═2NO2(g).在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如图2).
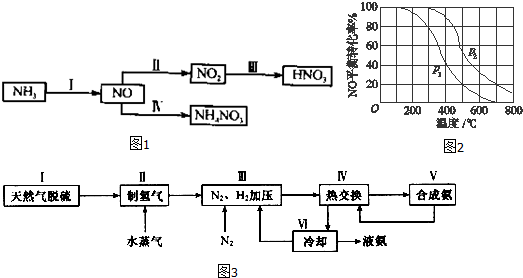
①随温度升高,该反应平衡向 (选填“正反应”或“逆反应”)方向移动.
②比较P1、P2的大小关系: .
(2)一种工业合成氨的简易流程图如图3:步骤Ⅱ中制氢气原理如下:
a.CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.4kJ/mol
b.CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ/mol
①对于反应a而言,增大 CH4的浓度,达新平衡时H2的体积分数 增大(选填“一定”或“不一定”).
②利用反应b,将CO进一步转化,可提高H2产量.若在500℃时,把等浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005mol?L-1、c(H2)=0.015mol?L-1,则CO的平衡转化率为 .
③上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号) ,④简述一种本流程中可以提高合成氨原料总转化率的方法 .
(1)NH3经一系列反应可以得到HNO3和NH4NO3.(如图1)Ⅱ中,2NO(g)+O2(g)═2NO2(g).在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如图2).

①随温度升高,该反应平衡向
②比较P1、P2的大小关系:
(2)一种工业合成氨的简易流程图如图3:步骤Ⅱ中制氢气原理如下:
a.CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.4kJ/mol
b.CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ/mol
①对于反应a而言,增大 CH4的浓度,达新平衡时H2的体积分数
②利用反应b,将CO进一步转化,可提高H2产量.若在500℃时,把等浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005mol?L-1、c(H2)=0.015mol?L-1,则CO的平衡转化率为
③上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号)
考点:转化率随温度、压强的变化曲线,热化学方程式,化学平衡的计算
专题:化学平衡专题
分析:(1)①根据图象知,相同压强下,升高温度,NO转化率减小,说明正反应是放热反应,据此判断化学平衡移动方向;
②相同温度下,增大压强,平衡向正反应方向移动,则NO的转化率增大;
(2)①若恒温恒压,平衡右移,达新平衡时H2的体积分数增大;若恒温恒容,平衡左移,达新平衡时H2的体积分数减小;
②根据平衡常数计算反应的CO的物质的量浓度,再结合转化率公式计算一氧化碳的转化率;
③依据反应是气体体积减小的放热反应,结合平衡移动原理分析判断.
②相同温度下,增大压强,平衡向正反应方向移动,则NO的转化率增大;
(2)①若恒温恒压,平衡右移,达新平衡时H2的体积分数增大;若恒温恒容,平衡左移,达新平衡时H2的体积分数减小;
②根据平衡常数计算反应的CO的物质的量浓度,再结合转化率公式计算一氧化碳的转化率;
③依据反应是气体体积减小的放热反应,结合平衡移动原理分析判断.
解答:
解:(1)①根据图象知,相同压强下,升高温度,NO转化率减小,说明正反应是放热反应,升高温度平衡向逆反应方向移动,故答案为:逆反应;
②相同温度下,增大压强,平衡向正反应方向移动,则NO的转化率增大,根据图象知,相同温度下,p2的转化率大于p1,所以p2>p1,故答案为:p2>p1;
(2)①若恒温恒压,平衡右移,达新平衡时H2的体积分数增大;若恒温恒容,平衡左移,达新平衡时H2的体积分数减小;故答案为:不一定;
根据反应方程式中各物质的关系式知,平衡时,c(CO)=0.005mol/L、c(H2)=0.015mo/L,参加反应的c(CO)=c(H2)=0.015mo/L,一氧化碳的转化率=
×100%=75%,
故答案为:75%;
③分析流程合成氨放热通过Ⅳ热交换器加热反应混合气体,使反应达到所需温度,提高合成氨原料总转化率,依据平衡移动原理分析,分离出氨气促进平衡正向进行,把平衡混合气体中氮气和氢气重新循环使用,提高原理利用率,
故答案为:Ⅳ;对原料气加压,分离液氨,未反应的氮气和氢气循环使用.
②相同温度下,增大压强,平衡向正反应方向移动,则NO的转化率增大,根据图象知,相同温度下,p2的转化率大于p1,所以p2>p1,故答案为:p2>p1;
(2)①若恒温恒压,平衡右移,达新平衡时H2的体积分数增大;若恒温恒容,平衡左移,达新平衡时H2的体积分数减小;故答案为:不一定;
根据反应方程式中各物质的关系式知,平衡时,c(CO)=0.005mol/L、c(H2)=0.015mo/L,参加反应的c(CO)=c(H2)=0.015mo/L,一氧化碳的转化率=
| 0.015mol/L |
| 0.005mol/L+0.015mol/L |
故答案为:75%;
③分析流程合成氨放热通过Ⅳ热交换器加热反应混合气体,使反应达到所需温度,提高合成氨原料总转化率,依据平衡移动原理分析,分离出氨气促进平衡正向进行,把平衡混合气体中氮气和氢气重新循环使用,提高原理利用率,
故答案为:Ⅳ;对原料气加压,分离液氨,未反应的氮气和氢气循环使用.
点评:本题考查了化学平衡影响因素分析,平衡计算应用,注意反应特征的计算应用,掌握基础是关键,题目难度较大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、醋酸溶液中滴入石蕊呈红色,证明醋酸是弱电解质 |
| B、液态HCl不导电,证明HCl是共价化合物 |
| C、饱和石灰水中加入少量CaO,恢复至室温,溶液的pH增大 |
| D、向Na2CO3溶液中加入少量NaOH固体,抑制CO32-水解,溶液pH减小 |
下列溶液中,溶质的物质的量浓度为1mol/L的是( )
| A、将40 g NaOH溶于1 L 水所得的溶液 |
| B、K+为0.5 mol的K2SO4溶液 |
| C、将0.5 mol/L的NaNO3溶液100 mL 加热蒸发掉50 g水所得的溶液 |
| D、含0.2molNO3-的Cu(NO3)2溶液100mL |
下列物质中,物质的量为0.4mol的是( )
| A、6.4gO2 |
| B、1.1 gCO2 |
| C、7.2 gH2O |
| D、49 gH2SO4 |
下列说法正确的是( )
| A、标准状况下,33.6 L SO3中含有的氧原子数是4.5NA |
| B、1 mol OH-和1 mol-OH(羟基)中含有的电子数均为9NA |
| C、在加热条件下,100 mL18.4 mol/L的浓硫酸与足量金属铜反应得到的SO2的分子数为0.92 NA |
| D、当0.2 mol Na218O2与足量CO2完全反应后,生成碳酸钠的质量为21.6 g |
下列关于酸碱反应的说法正确的是( )
| A、常温下,pH=2的HCl与pH=12的NH3?H2O 等体积混合后溶液呈酸性 |
| B、常温下,用pH=2和pH=3的醋酸溶液中和含等量NaOH的溶液所消耗醋酸溶液体积分别为Va,Vb,则Vb<10Va |
| C、常温下,向体积为V1L的浓度均为0.1mol/L HCl、CH3COOH混合溶液中加入 V2L 0.2mol/L的NaOH溶液后,溶液呈中性,则V1>V2 |
| D、常温下,pH为2的硫酸与0.01mol/L的NaOH溶液等体积混合后,混合溶液显酸性 |
