题目内容
已知:A、B、C、D为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;D的基态原子的M电子层上有4个未成对电子.
请回答下列问题:
(1)D是元素周期表中第 周期,第 族的元素;其基态原子的外围电子排布式为 .
(2)A、B、C、D四种元素中,电负性最大的是 (填元素符号).
(3)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为 .B的氢化物的沸点远高于A的氢化物的主要原因是 .
(4)D能与AC分子形成D(AC)5,其原因是AC分子中含有 .D(AC)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断D(AC)5晶体属于 (填晶体类型).
(5)SiO2的晶胞可作如下推导:先将NaCl晶胞中的所有Cl-去掉,并将Na+全部换成Si原子,再在每两个不共面的“小立方体”中心处各放置一个Si原子便构成了晶体Si的一个晶胞.再在每两个相邻的Si原子(距离最近的两个Si原子)中心联线的中点处增添一个O原子,便构成了SiO2晶胞,故SiO2晶胞中有 个Si原子, 个O原子.
请回答下列问题:
(1)D是元素周期表中第
(2)A、B、C、D四种元素中,电负性最大的是
(3)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为
(4)D能与AC分子形成D(AC)5,其原因是AC分子中含有
(5)SiO2的晶胞可作如下推导:先将NaCl晶胞中的所有Cl-去掉,并将Na+全部换成Si原子,再在每两个不共面的“小立方体”中心处各放置一个Si原子便构成了晶体Si的一个晶胞.再在每两个相邻的Si原子(距离最近的两个Si原子)中心联线的中点处增添一个O原子,便构成了SiO2晶胞,故SiO2晶胞中有
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等,核外电子排布为1s22s22p2,则A为碳元素;C的基态原子2p能级上的未成对电子数与A原子相同,核外电子排布为1s22s22p4,则C为O元素;B元素原子序数介于碳、氧之间,则B为N元素;D的基态原子的M电子层上有4个未成对电子,核外电子排布为1s22s22p63s23p63d64s2,则D为Fe,据此解答.
解答:
解:A、B、C、D为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等,核外电子排布为1s22s22p2,则A为碳元素;C的基态原子2p能级上的未成对电子数与A原子相同,核外电子排布为1s22s22p4,则C为O元素;B元素原子序数介于碳、氧之间,则B为N元素;D的基态原子的M电子层上有4个未成对电子,核外电子排布为1s22s22p63s23p63d64s2,则D为Fe,
(1)D为Fe元素,在周期表中处于第四周期第Ⅷ族,其基态原子的外围电子排布式为3d64s2,故答案为:四;Ⅷ;3d64s2;
(2)同周期自左而右电负性增大,非金属性越强电负性越大,故四种元素中,电负性最大的是O,故答案为:O;
(3)OCN-与CO2互为等电子体,二者结构相似C原子与O、N原子之间分别形成2对共用电子对,没有孤电子对,故C原子杂化轨道数目为2,采取sp杂化;由于NH3分子间能形成氢键,其沸点高于CH4,
故答案为:sp;NH3分子间能形成氢键;
(4)Fe能与CO分子形成Fe(CO)5,属于配合物,其原因是CO分子中含有孤对电子,Fe原子含有空轨道;Fe(Co)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断fE(CO)5晶体属于分子晶体,
故答案为:孤对电子;分子晶体;
(5)NaCl晶胞如图: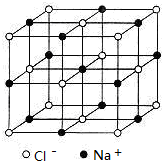 ,则黑球可以看成是Si原子,“小立方体”中可放置四个Si原子,故SiO2晶胞中有4+1+12×
,则黑球可以看成是Si原子,“小立方体”中可放置四个Si原子,故SiO2晶胞中有4+1+12×
=8个Si原子;设“小立方体”的边长为a,中心Si原子与小立方体中心Si原子的距离为
a<
a,故最近的两个Si原子的距离是
a,故含有的O原子数为4×4=16个,
故答案为:8;16.
(1)D为Fe元素,在周期表中处于第四周期第Ⅷ族,其基态原子的外围电子排布式为3d64s2,故答案为:四;Ⅷ;3d64s2;
(2)同周期自左而右电负性增大,非金属性越强电负性越大,故四种元素中,电负性最大的是O,故答案为:O;
(3)OCN-与CO2互为等电子体,二者结构相似C原子与O、N原子之间分别形成2对共用电子对,没有孤电子对,故C原子杂化轨道数目为2,采取sp杂化;由于NH3分子间能形成氢键,其沸点高于CH4,
故答案为:sp;NH3分子间能形成氢键;
(4)Fe能与CO分子形成Fe(CO)5,属于配合物,其原因是CO分子中含有孤对电子,Fe原子含有空轨道;Fe(Co)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断fE(CO)5晶体属于分子晶体,
故答案为:孤对电子;分子晶体;
(5)NaCl晶胞如图:
 ,则黑球可以看成是Si原子,“小立方体”中可放置四个Si原子,故SiO2晶胞中有4+1+12×
,则黑球可以看成是Si原子,“小立方体”中可放置四个Si原子,故SiO2晶胞中有4+1+12×| 1 |
| 4 |
| ||
| 2 |
| 2 |
| ||
| 2 |
故答案为:8;16.
点评:本题是对物质结构的考查,涉及核外电子排布、电负性、杂化轨道、晶体类型与性质、晶胞计算等,(5)为易错点、难点,需要学生具备一定的空间想象,难点中等.

练习册系列答案
相关题目
下列关于胶体的说法中正确的是( )
| A、胶体的直径大小在1-100nm之间 |
| B、胶体不稳定,静置后产生沉淀 |
| C、胶体的本质特征是丁达尔效应 |
| D、胶粒做不停的,无秩序的运动 |
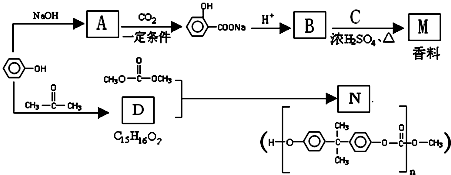
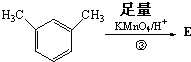 ,则E的分子式为
,则E的分子式为 结构在上述同分异构体中,有一类有机物分子中苯环上只有2个取代基,写出其中任一种与足量NaOH溶液共热反应的化学方程式
结构在上述同分异构体中,有一类有机物分子中苯环上只有2个取代基,写出其中任一种与足量NaOH溶液共热反应的化学方程式