题目内容
NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A、25℃时,Ph=12的NaOH溶液中含有OH-的数目为0.01NA |
| B、1L 0.25mol.L-1醋酸溶液中含CH3COOH分子数为0.25NA |
| C、7.8gNa2O2中阴阳离子总数为0.4NA |
| D、标准状况下,2.24L氧气与氮气的混合气体所含分子数为0.1NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.缺少氢氧化钠溶液的体积,无法计算溶液中氢氧根离子的数目;
B.醋酸为弱电解质,溶液中部分电离,导致醋酸分子数减少;
C.过氧化钠中的阴离子为过氧根离子,7.8g过氧化钠的物质的量为0.1mol,含有0.3mol离子;
D.标况下气体摩尔体积为22.4L/mol,2.24L氮气和氧气混合气体的物质的量为0.1mol.
B.醋酸为弱电解质,溶液中部分电离,导致醋酸分子数减少;
C.过氧化钠中的阴离子为过氧根离子,7.8g过氧化钠的物质的量为0.1mol,含有0.3mol离子;
D.标况下气体摩尔体积为22.4L/mol,2.24L氮气和氧气混合气体的物质的量为0.1mol.
解答:
解:A.没有告诉氢氧化钠溶液体积,无法计算溶液中氢氧根离子数目,故A错误;
B.1L 0.25mol.L-1醋酸溶液中含有溶质醋酸0.25mol,由于醋酸部分电离,溶液中醋酸分子小于0.25mol,含CH3COOH分子数小于0.25NA,故B错误;
C.7.8g过氧化钠的物质的量为0.1mol,0.1mol过氧化钠中含有0.2mol钠离子、0.1mol过氧根离子,总共含有0.3mol离子,含有的阴阳离子总数为0.3NA,故C错误;
D.标况下2.24L氧气与氮气的混合气体的物质的量为0.1mol,所含分子数为0.1NA,故D正确;
故选D.
B.1L 0.25mol.L-1醋酸溶液中含有溶质醋酸0.25mol,由于醋酸部分电离,溶液中醋酸分子小于0.25mol,含CH3COOH分子数小于0.25NA,故B错误;
C.7.8g过氧化钠的物质的量为0.1mol,0.1mol过氧化钠中含有0.2mol钠离子、0.1mol过氧根离子,总共含有0.3mol离子,含有的阴阳离子总数为0.3NA,故C错误;
D.标况下2.24L氧气与氮气的混合气体的物质的量为0.1mol,所含分子数为0.1NA,故D正确;
故选D.
点评:本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项A为易错点,需要明确题中缺少溶液体积;试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
 某恒容密闭容器中充入一定量SO2和O2进行反应:2SO2(g)+O2(g)?2SO3(g)△H<0.反应速率(v)与温度(T)、SO2的体积分数[v(SO2)%]与压强(P)的关系分别如图1、图2所示.下列说法不正确的是( )
某恒容密闭容器中充入一定量SO2和O2进行反应:2SO2(g)+O2(g)?2SO3(g)△H<0.反应速率(v)与温度(T)、SO2的体积分数[v(SO2)%]与压强(P)的关系分别如图1、图2所示.下列说法不正确的是( )| A、图1中,曲线Ⅰ表示逆反应速率与温度的关系 |
| B、图1中,d点表示温度为T0时,反应已经达到平衡 |
| C、图2中,温度恒定时,a、b两点对应的反应速率:va>vb |
| D、图2中,温度恒定时,c点的反应正在向逆反应方向进行 |
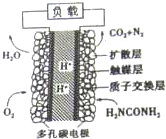 尿液也能发电,尿素燃料电池结构如图所示,用这种电池既能净化含氨废水,又能发电.下列关于该电池描述不正确的是( )
尿液也能发电,尿素燃料电池结构如图所示,用这种电池既能净化含氨废水,又能发电.下列关于该电池描述不正确的是( )| A、电流从左侧电极经过负载后流向右侧电极 |
| B、电池放电时,H+从正极向负极迁移 |
| C、电池的负极反应式:CO(NH2)2+H2O-6e-=N2+CO2+6H+ |
| D、电池降解1mol尿素,理论上消耗标准状况下33.6LO2 |
某可逆反应过程的能量变化如图所示,下列说法正确的是( )


| A、该反应能量变化类型与CaCO3分解反应相同 |
| B、加催化剂后,正反应速率加快,逆反应速率减少 |
| C、反应热△H=E2-E1 |
| D、若该反应为氧化还原反应,则可以将其设计成原电池 |
下列说法正确的是( )
| A、焓变大于0的反应一定是自发进行的反应 |
| B、吸热反应一定是非自发进行的 |
| C、自发进行的反应一定容易发生 |
| D、有些吸热反应也能自发进行 |
下列叙述中,正确的是( )
| A、硫酸的摩尔质量是98 |
| B、1mol氧的质量等于16g |
| C、摩尔是一个基本物理量 |
| D、以克为单位时,12g12C所含的原子数为阿伏伽德罗常数 |
下列说法中,正确的是( )
| A、饱和Ca(OH)2溶液中加入一定量的生石灰,恢复至原来的温度,得溶液的pH值会增大 |
| B、等体积、等pH的NH4Cl溶液和盐酸,完全溶解少量且等同的镁粉,前者反应快 |
| C、将nmol H2(g)、n mol I2(g)和2n mol H2(g)、2n mol I2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者 |
| D、某物质的溶液中由水电离出的c(H+)=1×10-amol.L-1,若α>7时,则该溶液的pH一定为14-α |