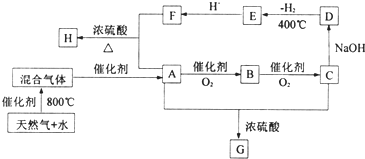
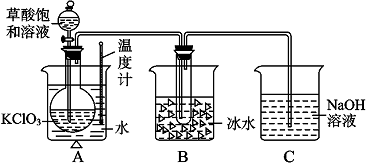
题目内容
某研究性学习小组用下列装置(铁架台等支撑仪器略)探究氧化铁与乙醇的反应,并检验反应产物.
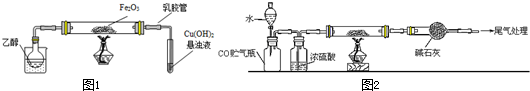
(1)组装好仪器后必须进行的操作是 ,用2%的CuSO4溶液和10%的NaOH溶液配制Cu(OH)2悬浊液的注意事项是 .
(2)如图2实验,观察到红色的Fe2O3全部变为黑色固体(M),为了检验M的组成,加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成;经检验溶液中有铁离子和亚铁离子,检验它们的方法分别是 ; .
(3)若M的成份可表达为FeXOY,用CO还原法定量测定其化学组成.称取a g M样品进行定量测定,实验装置和步骤如图2:
①组装仪器;②点燃酒精灯;③加入试剂; ④打开分液漏斗活塞;⑤检查气密性;⑥停止加热;⑦关闭分液漏斗活塞.正确的操作顺序是 (填写编号)
a.①⑤④③②⑥⑦b.①③⑤④②⑦⑥c.①⑤③④②⑥⑦d.①③⑤②④⑥⑦
(4).若实验中每步反应都进行完全,反应后M样品质量减小b g,则FeXOY中
= .

(1)组装好仪器后必须进行的操作是
(2)如图2实验,观察到红色的Fe2O3全部变为黑色固体(M),为了检验M的组成,加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成;经检验溶液中有铁离子和亚铁离子,检验它们的方法分别是
(3)若M的成份可表达为FeXOY,用CO还原法定量测定其化学组成.称取a g M样品进行定量测定,实验装置和步骤如图2:
①组装仪器;②点燃酒精灯;③加入试剂; ④打开分液漏斗活塞;⑤检查气密性;⑥停止加热;⑦关闭分液漏斗活塞.正确的操作顺序是
a.①⑤④③②⑥⑦b.①③⑤④②⑦⑥c.①⑤③④②⑥⑦d.①③⑤②④⑥⑦
(4).若实验中每步反应都进行完全,反应后M样品质量减小b g,则FeXOY中
| x |
| y |
考点:性质实验方案的设计
专题:实验设计题
分析:(1)气体通过装置,实验前需要检验装置气密性;新制氢氧化铜浊液需要氢氧化钠溶液过量,在碱性溶液中才会和醛基反应生成氧化亚铜红色沉淀;
(2)依据铁离子的实验检验方法分析,铁离子加入硫氰酸钾溶液会变红色;利用亚铁离子具有还原性可以被高锰酸钾溶液氧化检验;
(3)实验过程依据反应原理和实验目的分析实验步骤为,组装装置,检验装置气密性,加入试剂,加入水把一氧化碳赶入后续装置,点燃酒精灯加热玻璃管,反应结束后停止加热,关闭分液漏斗活塞,玻璃管称量剩余固体,依据质量变化计算铁元素和氧元素物质的量之比;
(4)依据实验结果得到,铁的氧化物中减少的质量为氧元素的质量为bg,铁的质量为(a-b)g,依据元素物质的量计算得到比值.
(2)依据铁离子的实验检验方法分析,铁离子加入硫氰酸钾溶液会变红色;利用亚铁离子具有还原性可以被高锰酸钾溶液氧化检验;
(3)实验过程依据反应原理和实验目的分析实验步骤为,组装装置,检验装置气密性,加入试剂,加入水把一氧化碳赶入后续装置,点燃酒精灯加热玻璃管,反应结束后停止加热,关闭分液漏斗活塞,玻璃管称量剩余固体,依据质量变化计算铁元素和氧元素物质的量之比;
(4)依据实验结果得到,铁的氧化物中减少的质量为氧元素的质量为bg,铁的质量为(a-b)g,依据元素物质的量计算得到比值.
解答:
解:(1)依据装置图分析可知反应过程需要在气密性好的装置中进行,定量测定,所以气体通过装置,实验前需要检验装置气密性;新制氢氧化铜浊液需要氢氧化钠溶液过量,在碱性溶液中才会和醛基反应生成氧化亚铜红色沉淀,制备过程为在过量NaOH溶液中滴加数滴CuSO4溶液,
故答案为:检验装置气密性;在过量NaOH溶液中滴加数滴CuSO4溶液;
(2)依据铁离子的实验检验方法分析,铁离子加入硫氰酸钾溶液会变红色,取少量溶液加入KSCN溶液,变红色,则有Fe3+;向另一份溶液中加入酸化的高锰酸钾溶液,紫红色变浅或褪去证明含有亚铁离子;
故答案为:取少量溶液加入KSCN溶液,变红色,则有Fe3+;向另一份溶液中加入酸化的高锰酸钾溶液,紫红色变浅或褪去证明含有亚铁离子;
(3)实验过程依据反应原理和实验目的分析实验步骤为,组装装置,检验装置气密性,加入试剂,加入水把一氧化碳赶入后续装置,点燃酒精灯加热玻璃管,反应结束后停止加热,关闭分液漏斗活塞,玻璃管称量剩余固体,依据质量变化计算铁元素和氧元素物质的量之比,所以选c,
故答案为:c;
(4)由实验结果可知铁的氧化物中减少的质量为氧元素的质量为bg,铁的质量为(a-b)g,原子个数比为n(Fe):n(O)=
:
=
,
故答案为:
.
故答案为:检验装置气密性;在过量NaOH溶液中滴加数滴CuSO4溶液;
(2)依据铁离子的实验检验方法分析,铁离子加入硫氰酸钾溶液会变红色,取少量溶液加入KSCN溶液,变红色,则有Fe3+;向另一份溶液中加入酸化的高锰酸钾溶液,紫红色变浅或褪去证明含有亚铁离子;
故答案为:取少量溶液加入KSCN溶液,变红色,则有Fe3+;向另一份溶液中加入酸化的高锰酸钾溶液,紫红色变浅或褪去证明含有亚铁离子;
(3)实验过程依据反应原理和实验目的分析实验步骤为,组装装置,检验装置气密性,加入试剂,加入水把一氧化碳赶入后续装置,点燃酒精灯加热玻璃管,反应结束后停止加热,关闭分液漏斗活塞,玻璃管称量剩余固体,依据质量变化计算铁元素和氧元素物质的量之比,所以选c,
故答案为:c;
(4)由实验结果可知铁的氧化物中减少的质量为氧元素的质量为bg,铁的质量为(a-b)g,原子个数比为n(Fe):n(O)=
| a-b |
| 56 |
| b |
| 16 |
| 2(a-b) |
| 7b |
故答案为:
| 2(a-b) |
| 7b |
点评:本题考查了物质性质的实验探究和物质组成的分析判断,实验操作步骤的设计和完善,实验过程中的反应实质分析判断,现象的理解和应用是解题关键,题目难度中等.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A、25℃时,Ph=12的NaOH溶液中含有OH-的数目为0.01NA |
| B、1L 0.25mol.L-1醋酸溶液中含CH3COOH分子数为0.25NA |
| C、7.8gNa2O2中阴阳离子总数为0.4NA |
| D、标准状况下,2.24L氧气与氮气的混合气体所含分子数为0.1NA |
下列化学用语表达正确的是( )
A、硝基苯的结构简式: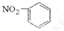 | ||
B、NH4Cl的电子式: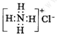 | ||
C、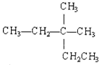 的名称为:3,3二甲基戍烷 的名称为:3,3二甲基戍烷 | ||
D、具有16个质子、16个种子和18个电子的微粒一定是
|