题目内容
13.试剂厂生产的FeCl3•6H2O试剂,国家规定二级产品的含量不低于99.0%,三级产品不低于98.0%.电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板.为检验产品的质量,称取0.5000g样品,溶于水后,加3mL HCl和2g KI,最后用0.1000mol/L的Na2S2O3标准溶液滴定,消耗18.17mL.
已知滴定过程中发生:I2+2Na2S2O3→2NaI+Na2S4O6
(1)配制250mL 0.1000mol/L的Na2S2O3标准溶液,需要称取5.950g Na2S2O3•5H2O(保留四位有效数字,下同).
(2)该产品属于三级.
分析 (1)根据n=cV计算Na2S2O3的物质的量,Na2S2O3与Na2S2O3•5H2O的物质的量相等,再根据m=nM计算Na2S2O3•5H2O;
(2)由电子转移守恒可知关系式:2FeCl3•6H2O~I2,再结合I2+2Na2S2O3=2NaI+Na2S4O6,可得关系式:2FeCl3•6H2O~I2~2Na2S2O3,结合消耗的Na2S2O3计算.
解答 解:(1)n(Na2S2O3•5H2O)=n(Na2S2O3)=0.25L×0.1000mol/L=0.025mol,则m(Na2S2O3•5H2O)=0.025mol×238g/mol=5.950g;
故答案为:5.950;
(2)由电子转移守恒可知关系式:2[FeCl3•6H2O]~I2,再结合I2+2Na2S2O3=2NaI+Na2S4O6,可得关系式:2FeCl3•6H2O~I2~2Na2S2O3,
设FeCl3•6H2O的含量为a,则:
2[FeCl3•6H2O]~I2~2Na2S2O3
2×270.5g 2mol
0.5000a g 0.01817L×0.1000mol/L
所以2×270.5g:0.5000a g=2mol:0.01817L×0.1000mol/L
解得a=98.19%
FeCl3•6H2O的含量低于99.0%,高于98.0%,属于三级产品,
故答案为:三.
点评 本题考查物质的量浓度计算、氧化还原反应滴定,注意利用关系式进行计算解答,较好的考查学生分析计算能力.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
3.如表实验操作正确且能达到预期目的是( )
| 实验目的 | 实验操作 | |
| A | 比较水和乙醇中羟基氢的活泼性强弱 | 用等量的金属钠分别与水和乙醇反应 |
| B | 检验溴乙烷中含有溴元素 | 先加NaOH溶液共热,然后加入AgNO3溶液 |
| C | 证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液 |
| D | 除去苯中的少量苯酚 | 加入过量浓溴水,振荡后过滤 |
| A. | A | B. | B | C. | C | D. | D |
4.有关 分子结构的叙述中正确的是( )
分子结构的叙述中正确的是( )
 分子结构的叙述中正确的是( )
分子结构的叙述中正确的是( )| A. | 分子中一定在同一平面上的碳原子至少为5个 | |
| B. | 分子中可能在同一平面上的碳原子最多为8个 | |
| C. | 分子中所有的碳原子有可能都在同一平面上 | |
| D. | 分子中在同一直线上的碳原子数为4 |
1.下列有关电池的叙述正确的是( )
| A. | 锌锰电池工作一段时间后外皮会变薄 | |
| B. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| C. | 如图所示电池工作时,负极溶解3g,溶液质量减轻0.2g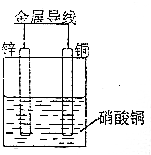 | |
| D. | 氢氧燃料电池工作时氢气在负极氧化 |
8.用如图所示装置进行实验.将少量液体逐滴加入到的固体乙中,试管中试剂为丙,则下表中现象正确的是( ) 

| 选项 | 甲 | 乙 | 丙 | 试管中现象 |
| A | 浓氨水 | 生石灰 | Al(SO4)3溶液 | 先沉淀后消失 |
| B | 浓硝酸 | 铜 | 淀粉KI溶液 | 试管口出现红棕色溶液仍为无色 |
| C | 浓盐酸 | 二氧化锰 | 石蕊溶液 | 先变红后褪色 |
| D | 双氧水 | 二氧化锰 | 氢硫酸 | 溶液出现浑浊 |
| A. | A | B. | B | C. | C | D. | D |
18.下列关于元素原子或离子半径的比较.正确的是( )
| A. | r(Al)>r(Si)>r(C)>r(N) | B. | r(Na+)<r(Mg2+)<r(Al3+)<r(F-) | ||
| C. | r(K+)>r(Ca2+)>r(S2-)>r(Cl-) | D. | r(N)<r(S)<r(O)<r(P) |
7.下列有关氧化还原反应的叙述中正确的是( )
| A. | 具有氧化性的物质在反应中一定做氧化剂 | |
| B. | 氧化还原反应的实质是电子转移 | |
| C. | 某元素从游离态变为化合态,该元素一定被氧化 | |
| D. | 反应中当有一种元素被氧化时,一定有另一种元素被还原 |
5.下列各组有机物不是同分异构体的是( )
| A. | CH3CH2CH2OH和CH3-O-CH2CH3 | B. |  | ||
| C. |  和CH3(CH2)2CHO 和CH3(CH2)2CHO | D. |  |
 .
.