题目内容
13.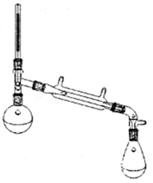 环乙烯是一种重要的化工原料,实验室常用下列反应制备环乙烯:
环乙烯是一种重要的化工原料,实验室常用下列反应制备环乙烯: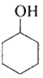 $→_{△}^{H_{2}SO_{4}}$
$→_{△}^{H_{2}SO_{4}}$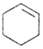 +H2O
+H2O环己醇、环己烯的部分物理性质见表:
| 物质 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己烯 | 83(70.8)* | 0.8085 | 不溶于水 |
Ⅰ:制备环己烯粗品.实验中将环己醇与浓硫酸混合加入烧瓶中,按图所示装置,油浴加热,蒸馏约1h,收集馏分,得到主要含环己烯和水的混合物.
Ⅱ:环己烯的提纯.主要操作有abcde;
a.向馏出液中加入精盐至饱和;
b.加入3~4mL5%Na2CO3溶液;
c.静置,分液;
d.加入无水CaCl2固体;
e.蒸馏
回答下列问题:
(1)油浴加热过程中,温度控制在90℃以下,蒸馏稳定不宜过高的原因是减少未反应的环己醇蒸出.
(2)蒸馏不能彻底分离环己烯和水的原因是环己烯和水形成具有固定组成的混合物一起被蒸发.
(3)加入精盐至饱和的目的是增加水层的密度,有利于分层.
(4)加入3~4mL5%Na2CO3溶液的作用是中和产品中混有的微量的酸
(5)加入无水CaCl2固体的作用是除去有机物中少量的水
(6)利用核磁共振氢谱可以鉴定制备的产物是否为环己烯,环己烯分子中有 种不同环境的氢原子3.
分析 (1)油浴加热过程中,温度控制在90℃以下,温度过高,未反应的环己醇蒸出,不利于反应的进行;
(2)由题可知环己烯和水形成具有固定组成的混合物,蒸馏时一起被蒸发;
(3)向馏出液中加入精盐至饱和,增加水层的密度,有利于分层;
(4)加入3~4mL5%Na2CO3溶液的作用是中和产品中混有的微量的酸;
(5)无水CaCl2固体可除去有机物中少量的水;
(6)环己烯为对称结构,有3种H原子.
解答 解:(1)油浴加热过程中,温度控制在90℃以下,温度过高,未反应的环己醇蒸出,不利于反应的进行;
故答案为:减少未反应的环己醇蒸出;
(2)由题可知环己烯和水形成具有固定组成的混合物,蒸馏时一起被蒸发,蒸馏不能彻底分离环己烯和水;
故答案为:环己烯和水形成具有固定组成的混合物一起被蒸发;
(3)向馏出液中加入精盐至饱和,增加水层的密度,有利于分层;
故答案为:增加水层的密度,有利于分层;
(4)产品中混有微量的酸,加入3~4mL5%Na2CO3溶液的作用是中和产品中混有的微量的酸;
故答案为:中和产品中混有的微量的酸;
(5)无水CaCl2固体可除去有机物中少量的水;
故答案为:除去有机物中少量的水;
(6)环己烯为对称结构,有双键碳氢、双键邻位-CH2-氢、双键间位-CH2-氢3种氢原子;
故答案为:3.
点评 本题考查有机物的结构与性质、物质的分离提纯、实验条件的控制,注意把握结构中的官能团及性质的关系,以及利用题目信息,题目难度中等.

练习册系列答案
相关题目
3.常温下,在某密闭容器中充入a摩尔H2S和b摩尔SO2,测得反应后溶器内压强为反应前的一半,则a:b为( )
| A. | 1:2 | B. | 2:3 | C. | 4:5 | D. | 5:1 |
4.下列离子方程式不正确的是( )
| A. | 氯气和水反应:Cl2+H2O?H++Cl-+HClO | |
| B. | 铁与稀盐酸反应:Fe+2H+═Fe2++H2↑ | |
| C. | 碳酸氢铵溶液与足量澄清石灰水反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 少量二氧化硫气体通入FeCl3溶液中:2Fe3++SO2+2H2O═2Fe2++4H++SO42- |
1.下列装置有关说法错误的是( )
| A. |  装置可以用来验证碳的非金属性比硅强 | |
| B. | 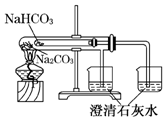 装置可以用来比较Na2CO3和NaHCO3的热稳定性 | |
| C. | 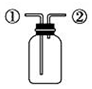 装置先从①口进气收集满二氧化碳,再从②口进气,可收集NO气体 | |
| D. | 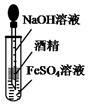 装置制备Fe(OH)2并能保证较长时间观察到白色 |
8.实验室采用下列装置制取氨气,正确的是( )
| A. |  生成NH3 | B. |  干燥NH3 | C. |  收集NH3并验满 | D. |  吸收多余NH3 |
5.一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )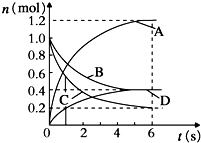

| A. | 该反应的化学方程式为3B+4D?6A+2C | |
| B. | 反应进行到1s时,v(A)=v(D) | |
| C. | 反应进行到6s时,各物质的反应速率相等 | |
| D. | 反应进行到6s时,B的平均反应速率为0.05mol/(L•s) |
12.下列说法不正确的是( )
| A. | 物质发生化学反应的反应热仅指反应放出的热量 | |
| B. | 热化学方程式中各物质的化学计量数只表示物质的量,不表示分子的个数 | |
| C. | 所有的燃烧反应都是放热的 | |
| D. | 热化学方程式中,化学式前面的化学计量数可以是分数 |
9.我国三峡工程所提供的清洁、廉价、强劲、可再生能源--水电,相当于每年燃烧3000万吨原煤的火力发电厂产生的电能,三峡工程有助于控制( )
①温室效应 ②形成酸雨 ③空气中的固体颗粒浓度 ④白色污染.
①温室效应 ②形成酸雨 ③空气中的固体颗粒浓度 ④白色污染.
| A. | 只有① | B. | 只有①② | C. | ②③④ | D. | ①②③ |
10.常温下,Ka(CH3COOH)=Kb(NH3•H2O)=1.75×10-5,下列说法正确的是( )
| A. | 用0.1mol•L-1的盐酸滴定0.1mol•L-1的氨水时,可用酚酞作指示剂 | |
| B. | 0.2 mol•L-1的醋酸与0.1 mol•L-1的氢氧化钠溶液等体积混合,所得溶液中:c(CH3COO-)+c(OH-)=C(CH3COOH)+C(H+) | |
| C. | pH=3的醋酸与pH=11的氨水等体积混合,所得溶液中有水电离出的C(H+)=1×10-7 mol•L-1 | |
| D. | pH=3的盐酸与pH=11的氨水等体积混合,所得溶液中C(NH3•H2O)>C(NH4+)>C(Cl-) |