题目内容
4.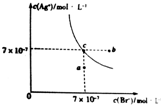 已知t℃时AgCl的Ksp=4×10-10,在此温下AgBr在水中的沉淀溶解平衡曲线如图所示.下列有关说法正确的是( )
已知t℃时AgCl的Ksp=4×10-10,在此温下AgBr在水中的沉淀溶解平衡曲线如图所示.下列有关说法正确的是( )| A. | t℃时,图中a点到c点所示溶液变化状态可加入AgBr固体 | |
| B. | 在AgBr饱和溶液中加入NaBr固体,可使溶液状态由c点到b点 | |
| C. | 在t℃时,AgCl(s)+Br-(aq)?AgBr(s)+Cl-(aq)平衡常数K=28.6 | |
| D. | 在t℃时,向含Br-、Cl-的溶液中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中$\frac{c(B{r}^{-})}{c(C{l}^{-})}$为1.225×10-3 |
分析 A.a点到c点,c(Br-)不变;
B.AgBr饱和溶液中加入NaBr固体,c(Br-)增大,溶解平衡逆向移动,c(Ag+)减小;
C.K=$\frac{c(C{l}^{-})}{c(B{r}^{-})}$=$\frac{Ksp(AgCl)}{Ksp(AgBr)}$;
D.AgCl沉淀生成时,Qc>Ksp,则c(Cl-)×$\frac{Ksp(AgBr)}{c(B{r}^{-})}$>Ksp(AgCl).
解答 解:A.a点到c点,c(Br-)不变,加入AgBr溶解平衡不移动,不能实现,故A错误;
B.AgBr饱和溶液中加入NaBr固体,c(Br-)增大,溶解平衡逆向移动,c(Ag+)减小,而c点到b点c(Ag+)不变,故B错误;
C.K=$\frac{c(C{l}^{-})}{c(B{r}^{-})}$=$\frac{Ksp(AgCl)}{Ksp(AgBr)}$=$\frac{4×1{0}^{-10}}{7×1{0}^{-7}×7×1{0}^{-7}}$=816,故C错误;
D.AgCl沉淀生成时,Qc>Ksp,则c(Cl-)×$\frac{Ksp(AgBr)}{c(B{r}^{-})}$>Ksp(AgCl),当AgCl开始沉淀时,溶液中$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=$\frac{4.9×1{0}^{-13}}{4×1{0}^{-10}}$=1.225×10-3,故D正确;
故选D.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握沉淀的生成、转化及Ksp计算为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的难点,题目难度不大.

练习册系列答案
相关题目
12.下列说法不正确的是( )
| A. | 物质发生化学反应的反应热仅指反应放出的热量 | |
| B. | 热化学方程式中各物质的化学计量数只表示物质的量,不表示分子的个数 | |
| C. | 所有的燃烧反应都是放热的 | |
| D. | 热化学方程式中,化学式前面的化学计量数可以是分数 |
10.常温下,Ka(CH3COOH)=Kb(NH3•H2O)=1.75×10-5,下列说法正确的是( )
| A. | 用0.1mol•L-1的盐酸滴定0.1mol•L-1的氨水时,可用酚酞作指示剂 | |
| B. | 0.2 mol•L-1的醋酸与0.1 mol•L-1的氢氧化钠溶液等体积混合,所得溶液中:c(CH3COO-)+c(OH-)=C(CH3COOH)+C(H+) | |
| C. | pH=3的醋酸与pH=11的氨水等体积混合,所得溶液中有水电离出的C(H+)=1×10-7 mol•L-1 | |
| D. | pH=3的盐酸与pH=11的氨水等体积混合,所得溶液中C(NH3•H2O)>C(NH4+)>C(Cl-) |
17.设NA为阿伏伽德罗常数的数值,下列有关叙述正确的是( )
| A. | 100g质量分数为46%的乙醇溶液中所含的氢原子数为12NA | |
| B. | pH=1的硫酸溶液中含有的SO42-数目为0.05NA | |
| C. | 向1L0.3mol•L-1NaOH溶液中通入0.2molCO2,溶液中CO32-和HCO3-的数目均为0.1NA | |
| D. | 0.2molNH3与0.3molO2在催化剂的作用下加热充分反应,所得NO的分子数为0.2NA |
9.已知还原性SO32->I-.某溶液中可能含有Na+、NH4+、Fe2+、K+、I-、SO32-、SO42-,且所有离子物质的量浓度相等.向该无色溶液中滴加少量溴水,溶液仍呈无色.下列关于该溶液的判正确的是( )
| A. | 肯定不含I- | B. | 肯定含有Na+ | ||
| C. | 肯定不含SO42-肯定含有SO32- | D. | 不能肯定是否含有SO42 |
16.电解水时,为了增强水的导电性且电解过程中pH保持不变,应加入的物质是( )
| A. | H2SO4 | B. | NaOH | C. | Na2SO4 | D. | CuCl2 |
13.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 50mL18mol•L-1浓硫酸与足量铜供热,转移电子数为0.9NA | |
| C. | 0.1molCl2通入含0.1molFeBr2溶液中,被氧化的溴离子数为0.2NA | |
| D. | 标准状况下,2.24LNO和足量O2反应生成物中含有NO2分子数为0.1NA |
14.下列有关物质的性质与用途具有对应关系的是( )
| A. | 碱石灰具有吸水性,可用于干燥氯气 | |
| B. | 甲醛能使蛋白质变性,可以用于食品防腐剂 | |
| C. | 炭具有强还原性,常用于冶炼钠、钾等金属 | |
| D. | 碳酸氢钠溶液具有弱碱性,可用于制胃酸中和剂 |