题目内容
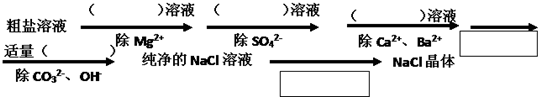
为了除去粗盐中含有的可溶性杂质CaCl2、MgCl2和Na2SO4,需进行下列实验操作.请在“括号”中填写所使用除杂试剂的化学式,在“方框”填写试验操作名称:

考点:粗盐提纯
专题:实验设计题
分析:把杂质转化为沉淀或气体除去,除钙离子用碳酸根离子,除镁离子用氢氧根离子,除硫酸根用钡离子.要注意除杂质的顺序,后加的试剂最好能把前面先加是过量试剂除掉.
解答:
解:除去粗盐中的可溶性杂质:Mg2+、Ca2+、SO42-的方法:
①加水溶解;
②加入过量NaOH(去除镁离子):Mg2++2OH-=Mg(OH)2↓;
③加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;
④加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3↓;
⑤过滤将沉淀和溶液分离;
⑥加过量的盐酸(除去多余的碳酸根离子、氢氧根离子),2H++CO32-=CO2↑+H2O;
⑦蒸发,让多余的盐酸以氯化氢的形式挥发.
故答案为:NaOH;BaCl2;Na2CO3;过滤;HCl;蒸发.
①加水溶解;
②加入过量NaOH(去除镁离子):Mg2++2OH-=Mg(OH)2↓;
③加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;
④加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3↓;
⑤过滤将沉淀和溶液分离;
⑥加过量的盐酸(除去多余的碳酸根离子、氢氧根离子),2H++CO32-=CO2↑+H2O;
⑦蒸发,让多余的盐酸以氯化氢的形式挥发.
故答案为:NaOH;BaCl2;Na2CO3;过滤;HCl;蒸发.
点评:本题主要考查了粗盐提纯过程中的除杂方面的知识,综合性强,要注意除杂质的顺序.

练习册系列答案
 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目
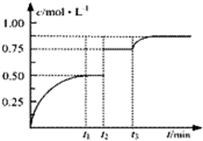 一定温度下,将1molA和1molB气体充入2L密闭容器,发生反应:A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确是( )
一定温度下,将1molA和1molB气体充入2L密闭容器,发生反应:A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确是( )| A、t1~t3间该反应的平衡常数均为4 |
| B、反应方程式中的x=1 |
| C、t2时刻改变的条件是使用催化剂 |
| D、t3时刻改变的条件是移去少量物质D |
X、Y、Z、W四种主族元素,若X的阳离子与Y的阴离子具有相同的电子层结构;W的阳离子的氧化性强于等电荷数的X阳离子的氧化性;Z阴离子半径大于等电荷数的Y的阴离子半径,下列说法不正确的是( )
| A、若W元素最高价氧化物对应的水化物为强碱,则X元素最高价氧化物对应的水化物不一定为强碱 |
| B、Y的氢化物比Z的氢化物更稳定 |
| C、原子序数:Z>X>Y>W |
| D、离子半径:Y>X |
下列做法中.不会造成大气污染的是( )
| A、燃烧含硫的煤 |
| B、焚烧树叶 |
| C、燃烧氢气 |
| D、燃放烟花爆竹 |
 存在,且不与H原子直接相连.燃料的氧化剂是N2O4,燃烧产物只有CO2、H2O、N2;5.00g“偏二甲肼”完全燃烧时可放出212.5kJ热量.
存在,且不与H原子直接相连.燃料的氧化剂是N2O4,燃烧产物只有CO2、H2O、N2;5.00g“偏二甲肼”完全燃烧时可放出212.5kJ热量.