题目内容
火箭的主要燃料是“偏二甲肼”,已知该化合物由C.H、N三种元素组成,WC=40%,WH=13.33%,其分子量为60.通过结构分析可知,该物质分子中其中有一个氮原子以 存在,且不与H原子直接相连.燃料的氧化剂是N2O4,燃烧产物只有CO2、H2O、N2;5.00g“偏二甲肼”完全燃烧时可放出212.5kJ热量.
存在,且不与H原子直接相连.燃料的氧化剂是N2O4,燃烧产物只有CO2、H2O、N2;5.00g“偏二甲肼”完全燃烧时可放出212.5kJ热量.
(1)试推算“偏二甲肼”的分子式,并写出它的结构简式.
(2)写出燃料燃烧的热化学方程式.
 存在,且不与H原子直接相连.燃料的氧化剂是N2O4,燃烧产物只有CO2、H2O、N2;5.00g“偏二甲肼”完全燃烧时可放出212.5kJ热量.
存在,且不与H原子直接相连.燃料的氧化剂是N2O4,燃烧产物只有CO2、H2O、N2;5.00g“偏二甲肼”完全燃烧时可放出212.5kJ热量.(1)试推算“偏二甲肼”的分子式,并写出它的结构简式.
(2)写出燃料燃烧的热化学方程式.
考点:热化学方程式,有机物实验式和分子式的确定
专题:化学反应中的能量变化,有机物分子组成通式的应用规律
分析:(1)根据分子中各个元素的质量分数来确定物质的分子式,据C、N、H分别能够形成共价键的个数为4、3、1和存在一个 推断;
推断;
(2)根据5g液态偏二甲肼与液态N2O4完全反应,生成气态的N2、H2O和CO2,同时放出212.5kJ热量来书写热化学方程式.
 推断;
推断;(2)根据5g液态偏二甲肼与液态N2O4完全反应,生成气态的N2、H2O和CO2,同时放出212.5kJ热量来书写热化学方程式.
解答:
解:(1)偏二甲肼含C、H、N三种元素,其中C、N、H元素的质量分数分别为40.0%、46.7%、13.3%,所以三种原子的个数比=各个原子的质量分数和相对原子质量比的比值,即C:H:N=
:
:
=1:4:1,所以偏二甲肼分子的最简式为:CH4N,偏二甲肼的相对分子质量是60,
即分子式为C2H8N2,C、N、H分别能够形成共价键的个数为4、3、1并存在一个 ,可推出其结构简式为:
,可推出其结构简式为: ,
,
答:分子式为C2H8N2,结构简式为 ;
;
(2)5.00g偏二甲肼的物质的量为:
=
mol,
液态偏二甲肼与液态N2O4完全反应,生成气态的N2、H2O和CO2,同时放出212.5kJ热量,则1mol液态偏二甲肼与液态N2O4完全反应,生成气态的N2、H2O和CO2,同时会放出2550kJ热量,热化学方程式为C2H8N2(1)+2N2O4(1)═2CO2(g)+4H2O(g)+3N2(g)△H=-2550 kJ?mol-1,
答:燃烧的热化学方程式为C2H8N2(1)+2N2O4(1)═2CO2(g)+4H2O(g)+3N2(g)△H=-2550 kJ?mol-1.
| 40% |
| 12 |
| 13.33% |
| 1 |
| 46.67% |
| 14 |
即分子式为C2H8N2,C、N、H分别能够形成共价键的个数为4、3、1并存在一个
 ,可推出其结构简式为:
,可推出其结构简式为: ,
,答:分子式为C2H8N2,结构简式为
 ;
;(2)5.00g偏二甲肼的物质的量为:
| 5.00g |
| 60g/mol |
| 1 |
| 12 |
| 1 |
| 12 |
答:燃烧的热化学方程式为C2H8N2(1)+2N2O4(1)═2CO2(g)+4H2O(g)+3N2(g)△H=-2550 kJ?mol-1.
点评:本题涉及分子式、结构式确定,热化学方程式书写等知识,要求学生具有分析和解决问题的能力,难度较大.

练习册系列答案
相关题目
下列关于环境问题的说法不正确的是( )
| A、在燃煤中加入CaO可以减少SO2的排放 |
| B、“白色污染”的发生说明有些合成材料的废弃物会造成严重的环境问题 |
| C、pH在5.6-7.0之间的降水通常称为酸雨 |
| D、废旧电池渗出的重金属离子会造成地下水和土壤的污染 |
 将物质的量均为2.0mol的物质X、Y混合,发生如下反应:2X(g)+Y(g)?2W(g).在反应过程中W的物质的量分数随温度变化如图所示,下列判断不正确的是( )
将物质的量均为2.0mol的物质X、Y混合,发生如下反应:2X(g)+Y(g)?2W(g).在反应过程中W的物质的量分数随温度变化如图所示,下列判断不正确的是( )| A、T0对应的V(正)和V(逆)的关系是:V(正)=V(逆) |
| B、此反应的正反应为放热反应 |
| C、A、B两点正反应速率的大小关系是:V(A)=V(B) |
| D、若B点的W的物质的量分数为50.0%,则参加反应的X的物质的量为1.6mol |
用金属铜制取硝酸铜,从节约原料和防止环境污染考虑,最好的方法是( )
A、Cu
| ||||
B、Cu
| ||||
C、Cu
| ||||
D、Cu
|
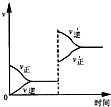 若平衡体系A+B═C+D,增大压强时反应速率变化如图所示.则下列关于各物质状态的说法正确的是( )
若平衡体系A+B═C+D,增大压强时反应速率变化如图所示.则下列关于各物质状态的说法正确的是( )| A、A、B、C、D都是气体 |
| B、C、D都是气体,A、B中有一种是气体 |
| C、A、B都不是气体,C、D中有一种是气体 |
| D、A、B都是气体,C、D中有一种是气体 |
有机物结构式可以简化,如: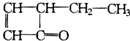 可表示为
可表示为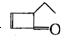 ,某有机物
,某有机物 的多种同分异构体中,属于芳香醇的一共有(不考虑立体异构)( )
的多种同分异构体中,属于芳香醇的一共有(不考虑立体异构)( )
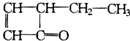 可表示为
可表示为 ,某有机物
,某有机物 的多种同分异构体中,属于芳香醇的一共有(不考虑立体异构)( )
的多种同分异构体中,属于芳香醇的一共有(不考虑立体异构)( )| A、6种 | B、5种 | C、4种 | D、3种 |
有一容积固定的密闭反应器,中间有一个可自由移动的导热的隔板将容器分成甲、乙两部分,分别发生下列两个可逆反应:
甲 乙
乙
甲:a(g)+b(g)?2c(g)△H1<0 乙:x(g)+3y(g)?2z(g)△H2>0
起初甲、乙均达到反应平衡后隔板位于正中间,然后进行相关操作后,下列叙述错误的是( )
甲
 乙
乙甲:a(g)+b(g)?2c(g)△H1<0 乙:x(g)+3y(g)?2z(g)△H2>0
起初甲、乙均达到反应平衡后隔板位于正中间,然后进行相关操作后,下列叙述错误的是( )
| A、绝热下向甲中通入惰性气体,c的物质的量不变 |
| B、绝热下向乙中通入z气体,反应器中温度升高 |
| C、恒温下向甲中通入惰性气体,甲中平衡不移动,乙中X、Y的转化率增大 |
| D、恒温下向乙中通入z气体,y的物质的量浓度增大 |