题目内容
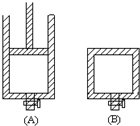 (1)用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/L H2SO4溶液来做中和热测定的实验,测得溶液在反应前后的温度变化为t1℃~t2℃(t2>t1),混合后溶液的比热容为c=4.18J/(g?℃),溶液的密度都近似为1g/mL,中和热△H=
(1)用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/L H2SO4溶液来做中和热测定的实验,测得溶液在反应前后的温度变化为t1℃~t2℃(t2>t1),混合后溶液的比热容为c=4.18J/(g?℃),溶液的密度都近似为1g/mL,中和热△H=(2)某高能化学物质N2H2内,氮元素的杂化类型为
(3).在密闭容器中进行可逆反应:CO(g)+NO2(g)?CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
①增大容器的体积,平衡
②容器体积不变:若通入CO2气体,平衡
(4)下表是几种常用燃料(1mol)完全燃烧时放出的热量:
| 物质 | 炭粉(C) | 一氧化碳(CO) | 氢气(H2) | 甲烷(CH4) | 乙醇(C2H5OH) |
| 状态 | 固体 | 气体 | 气体 | 气体 | 液体 |
| 热量(kJ) | 392.8 | 282.6 | 285.8 | 890.3 | 1 367 |
②写出管道煤气中的一氧化碳燃烧热的热化学方程式
③充分燃烧1mol表中各种燃料,排放出二氧化碳的量最多的是
④矿物燃料储量有限,而且在燃烧过程中会产生污染.根据能源多样化的发展战略,我国开发利用的绿色能源有
考点:反应热和焓变,有关反应热的计算,清洁能源,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)根据公式Q=cm△T来求出生成0.025mol的水放出热量,最后根据中和热的概念求出反应热;根据弱电解质电离要吸热,温度降低;浓硫酸稀释时放热,温度升高;
(2)N2H2内原子杂化类型和乙烯结构相似为SP2 杂化,分子中含有3个σ键,一个π键;
(3)①由于反应前后气体的化学计量数之和相等,压强对平衡移动没有影响,但反应物的浓度减小;
②增大二氧化碳的浓度,平衡向逆反应方向移动;
③催化剂对平衡移动无影响;
(4)根据题目所给的信息以及化学方程式进行解答.
(2)N2H2内原子杂化类型和乙烯结构相似为SP2 杂化,分子中含有3个σ键,一个π键;
(3)①由于反应前后气体的化学计量数之和相等,压强对平衡移动没有影响,但反应物的浓度减小;
②增大二氧化碳的浓度,平衡向逆反应方向移动;
③催化剂对平衡移动无影响;
(4)根据题目所给的信息以及化学方程式进行解答.
解答:
解:(1)50mL 0.55mol/L NaOH溶液和50mL 0.25ml/L H2SO4溶液反应生成0.25mol的水,溶液质量m=100mL×1g/mL=100g,c=4.18J/(g?℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18×10-3KJ/(g?℃)×100g×(t2-t1),所以生成1mol的水放出热量
,
即该实验测得的中和热△H=-
;
若将H2SO4溶液换成相同物质的量浓度的CH3COOH溶液,CH3COOH电离要吸热,温度降低,即变化值会偏小,测得的△H偏大;
若将稀硫酸换成浓硫酸来做该实验,浓硫酸稀释时放热,温度升高,即变化值会偏大,测得的△H偏小;
故答案为:-
;偏大;偏小;
(2)N2H2内原子杂化类型和乙烯结构相似为SP2 杂化,分子中含有3个σ键,一个π键,电子式为 ;
;
故答案为:sp2杂化; ;3;1;
;3;1;
(3)可逆反应CO(g)+NO2(g)?CO2(g)+NO(g);△H<0,该反应中,气体的化学计量数之和前后相等,反应放热,则:
①由于反应前后气体的化学计量数之和相等,压强对平衡移动没有影响,但由于体积增大,气体的物质的量不变,所以反应物的浓度减小,反应混合物的颜色变浅,
故答案为:不;变浅;
②增大二氧化碳的浓度,平衡向逆反应方向移动,二氧化氮的浓度增大,颜色变深,若通入N2气体,总压增大分压不变,平衡不变,浓度不变,反应混合物的颜色不变,故答案为:逆向;变深;不;不变;
③催化剂只改变反应速率,但不改变平衡移动,所以加入催化剂对平衡移动无影响,故答案为:不.
(4)①从热量角度分析可知,燃烧lmol甲烷放出的热量最多,所以目前最适合家庭使用的优质气体燃料是甲烷;故答案为:甲烷;
②1mol一氧化碳燃烧生成二氧化碳,放热282.6KJ,热化学方程式为:CO(g)+
O2 (g)
CO2(g)△H=-282.6KJ/mol;
故答案为:CO(g)+
O2 (g)
CO2(g)△H=-282.6KJ/mol;
③充分燃烧lmol表中各种燃料,生成二氧化碳的物质的量碳和甲烷是lmol;一氧化碳是0.5mol;而氢气燃烧不产生二氧化碳,乙醇燃烧产生2mol二氧化碳.所以充分燃烧lmol表中各种燃料,排放出二氧化碳的量最多的是乙醇;
故答案为:乙醇;
④根据绿色能源的含义就是无污染的能源,故绿色能源有氢能、风能、太阳能等,故答案为:氢能、风能、太阳能等.
| 4.18×10-3KJ/g?℃×100g×(t2-t1) |
| 0.025mol |
即该实验测得的中和热△H=-
| 4.18×10-3×100(t2-t1) |
| 0.025 |
若将H2SO4溶液换成相同物质的量浓度的CH3COOH溶液,CH3COOH电离要吸热,温度降低,即变化值会偏小,测得的△H偏大;
若将稀硫酸换成浓硫酸来做该实验,浓硫酸稀释时放热,温度升高,即变化值会偏大,测得的△H偏小;
故答案为:-
| 4.18×10-3×100(t2-t1) |
| 0.025 |
(2)N2H2内原子杂化类型和乙烯结构相似为SP2 杂化,分子中含有3个σ键,一个π键,电子式为
 ;
;故答案为:sp2杂化;
 ;3;1;
;3;1;(3)可逆反应CO(g)+NO2(g)?CO2(g)+NO(g);△H<0,该反应中,气体的化学计量数之和前后相等,反应放热,则:
①由于反应前后气体的化学计量数之和相等,压强对平衡移动没有影响,但由于体积增大,气体的物质的量不变,所以反应物的浓度减小,反应混合物的颜色变浅,
故答案为:不;变浅;
②增大二氧化碳的浓度,平衡向逆反应方向移动,二氧化氮的浓度增大,颜色变深,若通入N2气体,总压增大分压不变,平衡不变,浓度不变,反应混合物的颜色不变,故答案为:逆向;变深;不;不变;
③催化剂只改变反应速率,但不改变平衡移动,所以加入催化剂对平衡移动无影响,故答案为:不.
(4)①从热量角度分析可知,燃烧lmol甲烷放出的热量最多,所以目前最适合家庭使用的优质气体燃料是甲烷;故答案为:甲烷;
②1mol一氧化碳燃烧生成二氧化碳,放热282.6KJ,热化学方程式为:CO(g)+
| 1 |
| 2 |
| ||
故答案为:CO(g)+
| 1 |
| 2 |
| ||
③充分燃烧lmol表中各种燃料,生成二氧化碳的物质的量碳和甲烷是lmol;一氧化碳是0.5mol;而氢气燃烧不产生二氧化碳,乙醇燃烧产生2mol二氧化碳.所以充分燃烧lmol表中各种燃料,排放出二氧化碳的量最多的是乙醇;
故答案为:乙醇;
④根据绿色能源的含义就是无污染的能源,故绿色能源有氢能、风能、太阳能等,故答案为:氢能、风能、太阳能等.
点评:本题考查了化学反应能量变化,热化学方程式书写,化学平衡影响因素分析,此题是一道信息题,难度不大,考查的知识点较多,但是对于能源和环境污染题目是中考的一个重点也是热点,掌握基础是关键.

练习册系列答案
相关题目
