题目内容
某氮肥厂氨氮废水中氮元素多以NH4+和NH3?H2O的形式存在,该废水的处理流程如下:
氨氮废水
低浓度氨氮
含HNO3
达标废水
(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收.用离子方程式表示加NaOH溶液的作用: .
(2)过程Ⅱ:在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-.其中第一步反应的能量变化示意图如下:

第一步反应是 反应(选填“放热”或“吸热”),判断依据是 .
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2.若该反应消耗32g CH3OH转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 .
氨氮废水
| Ⅰ |
| Ⅱ |
| Ⅲ |
(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收.用离子方程式表示加NaOH溶液的作用:
(2)过程Ⅱ:在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-.其中第一步反应的能量变化示意图如下:

第一步反应是
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2.若该反应消耗32g CH3OH转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是
考点:物质的分离、提纯的基本方法选择与应用,化学方程式的有关计算
专题:计算题,实验设计题
分析:(1)铵根能和强碱反应生成一水合氨,加热生成氨气;
(2)反应物总能量高于生成物总能量,为放热反应;
(3)根据消耗甲醇的量和转移电子的量来书写方程式,并确定氧化剂和还原剂的量的多少.
(2)反应物总能量高于生成物总能量,为放热反应;
(3)根据消耗甲醇的量和转移电子的量来书写方程式,并确定氧化剂和还原剂的量的多少.
解答:
解:(1)铵盐和氢氧化钠在加热条件下反应生成氨气,反应的离子方程式为NH4++OH-
NH3↑+H2O,
故答案为:NH4++OH-
NH3↑+H2O;
(2)由图象可知,反应物总能量高于生成物总能量,为放热反应,
故答案为:放热;反应物总能量高于生成物总能量;
(3)消耗32g(1mol)CH3OH转移6mol电子,由CH3OH中碳原子的化合价升高6,所以反应后碳的化合价为+4,产物为CO2,
根据质量守恒和化合价升降总数相等得:5CH3OH+6HNO3═5CO2+3N2+13H2O,反应中氧化剂是硝酸,还原剂是甲醇,参加反应的还原剂和氧化剂的物质的量之比是5:6,
故答案为:5:6.
| ||
故答案为:NH4++OH-
| ||
(2)由图象可知,反应物总能量高于生成物总能量,为放热反应,
故答案为:放热;反应物总能量高于生成物总能量;
(3)消耗32g(1mol)CH3OH转移6mol电子,由CH3OH中碳原子的化合价升高6,所以反应后碳的化合价为+4,产物为CO2,
根据质量守恒和化合价升降总数相等得:5CH3OH+6HNO3═5CO2+3N2+13H2O,反应中氧化剂是硝酸,还原剂是甲醇,参加反应的还原剂和氧化剂的物质的量之比是5:6,
故答案为:5:6.
点评:本题综合考查物质的分离提纯以及化学方程式的计算,为高频考点,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握相关物质的性质以及氧化还原反应的相关计算,难度不大.

练习册系列答案
相关题目
下列关于反应热的表述正确的是( )
| A、当△H<0时,表示该反应为吸热反应 |
| B、需要加热才能进行的反应是吸热反应 |
| C、反应热的大小与反应物所具有的能量和生成物所具有的能量有关 |
| D、1molNaOH分别和1molCH3COOH、1molHNO3反应放出的热量:CH3COOH=HNO3 |
 (1)用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/L H2SO4溶液来做中和热测定的实验,测得溶液在反应前后的温度变化为t1℃~t2℃(t2>t1),混合后溶液的比热容为c=4.18J/(g?℃),溶液的密度都近似为1g/mL,中和热△H=
(1)用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/L H2SO4溶液来做中和热测定的实验,测得溶液在反应前后的温度变化为t1℃~t2℃(t2>t1),混合后溶液的比热容为c=4.18J/(g?℃),溶液的密度都近似为1g/mL,中和热△H=
 (1)将各有机物的序号填到对应分类中 ①CH3CH2CH3②CH2=CH-CH3③CH3COOCH3④H3C-OH⑤CH3CH2COOH 醇:
(1)将各有机物的序号填到对应分类中 ①CH3CH2CH3②CH2=CH-CH3③CH3COOCH3④H3C-OH⑤CH3CH2COOH 醇: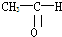 烯烃:
烯烃: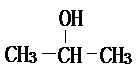 中的一种,根据图中信息,其结构简式为:
中的一种,根据图中信息,其结构简式为: