题目内容
查找资料发现,N2制取有下列不同方案:
a方案:加热条件下NH3还原CuO制得纯净的N2和活性铜粉
b方案:加热NaNO2和NH4Cl的浓溶液制得
c方案:将空气缓慢地通过灼热的铜粉制得较纯的N2
现实验室有供选择的如下几种仪器来制取N2

(1)若按a方案制N2时,需要的氨气用生石灰和浓氨水作原料制取,则宜采用上述仪器中的 (填A、B、C…下同)作NH3的发生器,要制取并收集N2,还须选用到的仪器是 .
(2)写出b方案中反应的化学方程式
(3)若按c方案制取N2,则氮气中一定混有何种杂质气体
(4)上述制N2的三个方案中,a、c方案结合使用越来越受到人们的关注,这种方法与b方案相比,其优越性在于 .
a方案:加热条件下NH3还原CuO制得纯净的N2和活性铜粉
b方案:加热NaNO2和NH4Cl的浓溶液制得
c方案:将空气缓慢地通过灼热的铜粉制得较纯的N2
现实验室有供选择的如下几种仪器来制取N2

(1)若按a方案制N2时,需要的氨气用生石灰和浓氨水作原料制取,则宜采用上述仪器中的
(2)写出b方案中反应的化学方程式
(3)若按c方案制取N2,则氮气中一定混有何种杂质气体
(4)上述制N2的三个方案中,a、c方案结合使用越来越受到人们的关注,这种方法与b方案相比,其优越性在于
考点:常见气体制备原理及装置选择
专题:实验题
分析:(1)用生石灰和浓氨水作原料制取氨气,需选择固体和液体不需要加热制取气体的装置,提供的装置E符合条件,根据制取并收集纯净的N2的原理选择装置;
(2)b方案中,加热NaNO2和NH4Cl的浓溶液生成氮气、氯化钠和水;
(3)根据空气的主要成分分析;
(4)依据制备过程分析,a、b中Cu 和 CuO 可以循环使用,NaNO2有毒.
(2)b方案中,加热NaNO2和NH4Cl的浓溶液生成氮气、氯化钠和水;
(3)根据空气的主要成分分析;
(4)依据制备过程分析,a、b中Cu 和 CuO 可以循环使用,NaNO2有毒.
解答:
解:(1)浓氨水易挥发,CaO固体与水反应放出大量的热,导致温度升高,使得氨气在水中的溶解度进一步减少,以气体的形式逸出,制得氨气,题中所给的装置,适用于制备气体的发生装置的是E,发生的化学反应为:NH3?H2O+CaO═Ca(OH)2+NH3↑,氨气中混有水蒸气,故可用碱石灰干燥,选用D装置,氨气和氧化铜在A装置中反应,反应方程式为:2NH3+3CuO
3Cu+N2↑+3H2O,按方案a制取N2中会含有未反应的氨气,因此,还需要用试剂吸收氨气,由于氨气是一种碱性气体,所以用浓硫酸来吸收氮气中的氨气,选用C装置,
故答案为:E;ACD;
(2)b方案的目的也是制取氮气,加热NaNO2和NH4Cl的浓溶液生成氮气、氯化钠和水,化学方程式为:NH4Cl+NaNO2═N2↑+2H2O+NaCl,
故答案为:NH4Cl+NaNO2═N2↑+2H2O+NaCl;
(3)空气的主要成分为氮气和氧气,还含有少量的稀有气体等,c方案中,氧气被灼热的铜粉消耗掉,得到的氮气中混有稀有气体等杂质,
故答案为:稀有气体;
(4)从制备过程看,方案a和b能得到纯净的氮气,本方案中产生有毒物质NaNO2,而方案c制取的氮气中混有稀有气体、二氧化碳、水蒸气等物质,
故方案3氮气纯度最差;方案a和c反应原理简单,原料来源多,铜和氧化铜可以循环利用;
故答案为:铜与氧化铜可循环使用,避开有毒的NaNO2.
| ||
故答案为:E;ACD;
(2)b方案的目的也是制取氮气,加热NaNO2和NH4Cl的浓溶液生成氮气、氯化钠和水,化学方程式为:NH4Cl+NaNO2═N2↑+2H2O+NaCl,
故答案为:NH4Cl+NaNO2═N2↑+2H2O+NaCl;
(3)空气的主要成分为氮气和氧气,还含有少量的稀有气体等,c方案中,氧气被灼热的铜粉消耗掉,得到的氮气中混有稀有气体等杂质,
故答案为:稀有气体;
(4)从制备过程看,方案a和b能得到纯净的氮气,本方案中产生有毒物质NaNO2,而方案c制取的氮气中混有稀有气体、二氧化碳、水蒸气等物质,
故方案3氮气纯度最差;方案a和c反应原理简单,原料来源多,铜和氧化铜可以循环利用;
故答案为:铜与氧化铜可循环使用,避开有毒的NaNO2.
点评:本题是一道关于三条途径按不同要求制取氮气的综合性实验评价题目,从题干信息中找突破口,根据信息将学过的知识进行迁移是解答本题的关键,题目难度中等.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
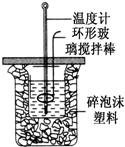 用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热.
用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热.
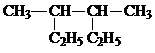 名称:
名称: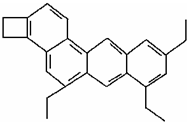
 以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一.
以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一.