题目内容
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C═2AlN+3CO
(1)在化学方程式上用双线桥标出该反应电子转移的方向和数目 .
(2)在反应中,氧化剂是 ,还原剂是 .
(1)在化学方程式上用双线桥标出该反应电子转移的方向和数目
(2)在反应中,氧化剂是
考点:氧化还原反应
专题:氧化还原反应专题
分析:Al2O3+N2+3C=2AlN+3CO中,N元素的化合价由0降低为-3价,C元素的化合价由0升高为+2价,该反应中转移6e-,以此来解答.
解答:
解:(1)Al2O3+N2+3C=2AlN+3CO中,N元素的化合价由0降低为-3价,C元素的化合价由0升高为+2价,该反应中转移6e-,则电子转移的方向和数目为 ,故答案为:
,故答案为: ;
;
(2)C元素的化合价升高,则C为还原剂,因N元素的化合价降低,则N2为氧化剂,故答案为:N2;C.
 ,故答案为:
,故答案为: ;
;(2)C元素的化合价升高,则C为还原剂,因N元素的化合价降低,则N2为氧化剂,故答案为:N2;C.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,注意从元素化合价角度分析,侧重基本概念和转移电子表示方法的考查,题目难度不大.

练习册系列答案
相关题目
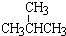 和
和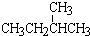 ; ②
; ② 和
和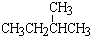 ;
;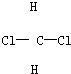 和
和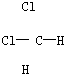

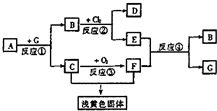 如下图为黑色固体化合物A(FeS)及其产物的一系列反应的框图,每一个方框表示有一种反应物或生成物(反应条件及反应所需和产生的水均略去),其中A、G为反应物,C、F在常温下均为气体.(已知:FeS+2H+=Fe2++H2S↑)
如下图为黑色固体化合物A(FeS)及其产物的一系列反应的框图,每一个方框表示有一种反应物或生成物(反应条件及反应所需和产生的水均略去),其中A、G为反应物,C、F在常温下均为气体.(已知:FeS+2H+=Fe2++H2S↑)