题目内容
工业上用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H
(1)下列状态下可以肯定该反应已达化学平衡的是 (填字母序号)
a.生成CH3OH的速率与消耗CO的速率相等
b.CH3OH、CO、H2的浓度不再发生变化
c.混合气体的相对平均分子质量不变
d.混合气体的密度不变
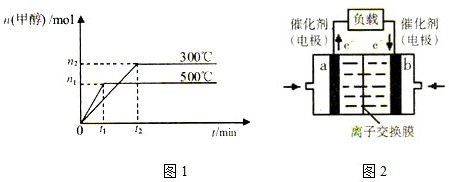
(2)如图1表示该反应在不同温度时甲醇的物质的量随时间的变化情况.
①由图中数据判断反应的△H 0(填“>”或“=”或“<”);选择适宜的催化剂, (填“能”或“不能”)改变该反应的反应热.
②300℃时反应达到平衡后,若其它条件不变,将容器体积缩小到原来的
,氢气物质的量的浓度将 (填“增大”或“减小”或“不变”)
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后达到平衡,测得c(CO)=0.2mol/L,则CO的转化率为 ;用CH3OH表示该过程的反应速率:v(CH3OH)= mol/(L?min)
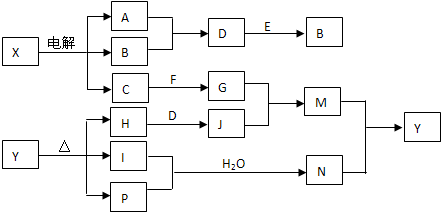
(3)如图2是甲醇燃料电池(电解质溶液为KOH溶液)结构示意图.写出a处电极的电极反应式 .
(4)64g甲醇在氧气中充分燃烧,将产物通入2L 1.5mol/L KOH溶液中充分反应后,溶液中离子浓度由大到小排列的顺序是 .

(1)下列状态下可以肯定该反应已达化学平衡的是
a.生成CH3OH的速率与消耗CO的速率相等
b.CH3OH、CO、H2的浓度不再发生变化
c.混合气体的相对平均分子质量不变
d.混合气体的密度不变
(2)如图1表示该反应在不同温度时甲醇的物质的量随时间的变化情况.
①由图中数据判断反应的△H
②300℃时反应达到平衡后,若其它条件不变,将容器体积缩小到原来的
| 1 |
| 2 |
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后达到平衡,测得c(CO)=0.2mol/L,则CO的转化率为
(3)如图2是甲醇燃料电池(电解质溶液为KOH溶液)结构示意图.写出a处电极的电极反应式
(4)64g甲醇在氧气中充分燃烧,将产物通入2L 1.5mol/L KOH溶液中充分反应后,溶液中离子浓度由大到小排列的顺序是
考点:化学平衡的计算,反应热和焓变,化学电源新型电池,化学平衡状态的判断
专题:基本概念与基本理论
分析:(1)根据化学平衡的特征判断;
(2)①根据温度对化学平衡的影响来回答,根据催化剂对平衡的影响作判断;
②根据压强对平衡的影响判断;
③利用三段式计算;
(3)a电极是电子流出的电极,为负极,则甲醇在此电极上失电子发生氧化反应,据此写电极反应式;
(4)根据燃烧产生的二氧化碳与KOH溶液反应的生成物结合盐类的水解知识排序.
(2)①根据温度对化学平衡的影响来回答,根据催化剂对平衡的影响作判断;
②根据压强对平衡的影响判断;
③利用三段式计算;
(3)a电极是电子流出的电极,为负极,则甲醇在此电极上失电子发生氧化反应,据此写电极反应式;
(4)根据燃烧产生的二氧化碳与KOH溶液反应的生成物结合盐类的水解知识排序.
解答:
解:(1)a.生成CH3OH的速率与消耗CO的速率相等,都是表示的正反应速率,不能判断反应是否处于平衡状态,故a错误;
b.CH3OH、CO、H2的浓度不再发生变化,说明反应已经处于平衡状态了,故b正确;
c.该反应气体质量守恒,反应前后物质的量不等,所以当混合气体的相对平均分子质量不变时,说明反应已经处于平衡状态,故c正确;
d.在反应前后体积和质量都不变,所以混合气体的密度不变不能判断反应是否处于平衡状态,故d错误;
故选bc;
(2)①由图可知,500℃是甲醇的物质的量少,即反应逆向移动,所以该反应的正反应为放热反应,△H<0,加入催化剂对平衡的移动没有影响,所以不改反应热,故答案为:<;不能;
②减小体积,压强增大,虽然平衡正向移动,但氢的浓度比起始要大,故答案为:增大;
③利用三段式计算,
CO(g)+2H2(g)?CH3OH(g)
起始(mol) 2 6 0
转化(mol) 1.6 1.6
平衡(mol) 0.2×2=0.4 1.6
CO的转化率为
×100%=80%
v(CH3OH)=
mol/(L?min)=0.08mol/(L?min)
故答案为:80%;0.08;
(3)a电极是电子流出的电极,为负极,则甲醇在此电极上失电子发生氧化反应,据此写电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
(4)64g甲醇燃烧产生的二氧化碳2mol与2L 1.5mol/LKOH溶液反应的生成2mol碳酸氢钾和1mol碳酸钾,碳酸根水解显碱性,可知溶液中离子浓度大小顺序为c(K+)>c(HCO3-)>c(CO32- )>c(OH-)>c(H+),故答案为:c(K+)>c(HCO3-)>c(CO32- )>c(OH-)>c(H+).
b.CH3OH、CO、H2的浓度不再发生变化,说明反应已经处于平衡状态了,故b正确;
c.该反应气体质量守恒,反应前后物质的量不等,所以当混合气体的相对平均分子质量不变时,说明反应已经处于平衡状态,故c正确;
d.在反应前后体积和质量都不变,所以混合气体的密度不变不能判断反应是否处于平衡状态,故d错误;
故选bc;
(2)①由图可知,500℃是甲醇的物质的量少,即反应逆向移动,所以该反应的正反应为放热反应,△H<0,加入催化剂对平衡的移动没有影响,所以不改反应热,故答案为:<;不能;
②减小体积,压强增大,虽然平衡正向移动,但氢的浓度比起始要大,故答案为:增大;
③利用三段式计算,
CO(g)+2H2(g)?CH3OH(g)
起始(mol) 2 6 0
转化(mol) 1.6 1.6
平衡(mol) 0.2×2=0.4 1.6
CO的转化率为
| 1.6 |
| 2 |
v(CH3OH)=
| ||
| 10 |
故答案为:80%;0.08;
(3)a电极是电子流出的电极,为负极,则甲醇在此电极上失电子发生氧化反应,据此写电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
(4)64g甲醇燃烧产生的二氧化碳2mol与2L 1.5mol/LKOH溶液反应的生成2mol碳酸氢钾和1mol碳酸钾,碳酸根水解显碱性,可知溶液中离子浓度大小顺序为c(K+)>c(HCO3-)>c(CO32- )>c(OH-)>c(H+),故答案为:c(K+)>c(HCO3-)>c(CO32- )>c(OH-)>c(H+).
点评:本题主要考查平衡状态的判断、影响平衡移动的因素、转化率、反应速率的计算、电极反应的书写,有一定的综合性,中等难度.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
火箭新兵“长三丙火箭”第三级推进器使用的燃料是液态氢,已知在298K时,2g H2与O2完全反应生成液态水时放热285.8kJ.则下列有关判断正确的是( )
| A、在298 K时,11.2 L H2完全燃烧生成液态水放出的热量为142.9 kJ | ||
| B、H2(g)的燃烧热是285.8 kJ,则2H2O(l)═2H2(g)+O2(g)△H=+571.6 kJ?mol-1 | ||
| C、在298 K时,2H2(g)+O2(g)═2H2O(g)△H<-571.6 kJ?mol-1 | ||
D、H2(g)+
|
 和
和 ; ②
; ② 和
和 ;
; 和
和
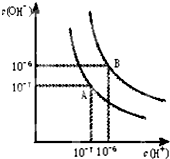 (1)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
(1)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),