题目内容
金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下:
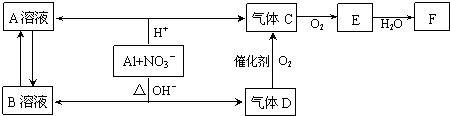
已知:气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀.请回答下列问题:
(1)A和B两溶液混合产生白色沉淀,该白色沉淀的化学式 .
(2)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质的电子式 .
(3)完成并配平下列离子方程式:Al+NO3-+OH-+H2O- .
(4)过量D的水溶液与A溶液反应的离子方程式是 .
(5)D→C反应的化学方程式是 .
(6)除去气体C中的杂质气体E的化学方法: (用化学方程式表示).
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是 .

已知:气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀.请回答下列问题:
(1)A和B两溶液混合产生白色沉淀,该白色沉淀的化学式
(2)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质的电子式
(3)完成并配平下列离子方程式:Al+NO3-+OH-+H2O-
(4)过量D的水溶液与A溶液反应的离子方程式是
(5)D→C反应的化学方程式是
(6)除去气体C中的杂质气体E的化学方法:
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是
考点:无机物的推断
专题:推断题
分析:金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,由转化关系图可知,在酸性环境下,反应生成铝盐和一氧化氮,碱性环境下生成偏铝酸盐和氨气,氨气催化氧化可以生成一氧化氮和水,一氧化氮可以和氧气反应生成二氧化氮,故A为硝酸铝,B为偏铝酸盐,C为NO,D为氨气,E为二氧化氮,F为硝酸,然后结合元素化合物性质及化学用语来解答.
解答:
解:金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,由转化关系图可知,在酸性环境下,反应生成铝盐和一氧化氮,碱性环境下生成偏铝酸盐和氨气,氨气催化氧化可以生成一氧化氮和水,一氧化氮可以和氧气反应生成二氧化氮,故A为硝酸铝,B为偏铝酸盐,C为NO,D为氨气,E为二氧化氮,F为硝酸,
(1)可溶性的铝盐可以和偏铝酸盐发生反应生成氢氧化铝白色沉淀,发生6H2O+3AlO2-+Al3+=4Al(OH)3↓,故答案为:Al(OH)3;
(2)氨气可以和一氧化氮或是二氧化氮发生氧化还原反应生成无毒气体氮气,氮气是氮原子之间通过共用电子对形成的单质,电子式为 ,
,
故答案为: ;
;
(3)金属铝在碱性环境下可以和硝酸跟反应生成偏铝酸盐和氨气,由电子、电荷守恒可知,离子反应为8Al+3NO3-+5OH-+2H2O=8AlO2-+3NH3↑,
故答案为:8Al+3NO3-+5OH-+2H2O=8AlO2-+3NH3↑;
(4)过量D溶液与A溶液反应的离子方程式是3NH3.H2O+Al3+=Al(OH)3↓+3NH4+,故答案为:3NH3.H2O+Al3+=Al(OH)3↓+3NH4+;
二氧化氮可以和水发生反应生成硝酸和一氧化氮,3NO2+H2O═2HNO3+NO,可以用水除去一氧化氮中的二氧化氮,故答案为:3NO2+H2O═2HNO3+NO;
(5)D→C反应的化学方程式是4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O;
(6)二氧化氮与水反应生成NO,则利用水洗气可除杂,即除去气体C中的杂质气体E的化学方法为3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
(7)Al与NO3-在酸性条件下反应,金属铝被氧化为三价的铝离子,失去电子3mol,硝酸根被还原为一氧化氮,得到电子也是3mol,根据电子守恒,Al与被还原的NO3-的物质的量之比是1:1,故答案为:1:1.
(1)可溶性的铝盐可以和偏铝酸盐发生反应生成氢氧化铝白色沉淀,发生6H2O+3AlO2-+Al3+=4Al(OH)3↓,故答案为:Al(OH)3;
(2)氨气可以和一氧化氮或是二氧化氮发生氧化还原反应生成无毒气体氮气,氮气是氮原子之间通过共用电子对形成的单质,电子式为
 ,
,故答案为:
 ;
;(3)金属铝在碱性环境下可以和硝酸跟反应生成偏铝酸盐和氨气,由电子、电荷守恒可知,离子反应为8Al+3NO3-+5OH-+2H2O=8AlO2-+3NH3↑,
故答案为:8Al+3NO3-+5OH-+2H2O=8AlO2-+3NH3↑;
(4)过量D溶液与A溶液反应的离子方程式是3NH3.H2O+Al3+=Al(OH)3↓+3NH4+,故答案为:3NH3.H2O+Al3+=Al(OH)3↓+3NH4+;
二氧化氮可以和水发生反应生成硝酸和一氧化氮,3NO2+H2O═2HNO3+NO,可以用水除去一氧化氮中的二氧化氮,故答案为:3NO2+H2O═2HNO3+NO;
(5)D→C反应的化学方程式是4NH3+5O2
| ||
| △ |
| ||
| △ |
(6)二氧化氮与水反应生成NO,则利用水洗气可除杂,即除去气体C中的杂质气体E的化学方法为3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
(7)Al与NO3-在酸性条件下反应,金属铝被氧化为三价的铝离子,失去电子3mol,硝酸根被还原为一氧化氮,得到电子也是3mol,根据电子守恒,Al与被还原的NO3-的物质的量之比是1:1,故答案为:1:1.
点评:本题考查无机物的推断,为高频考点,侧重Al及其化合物转化的考查,把握发生的氧化还原反应推断各物质为解答的关键,题目综合性较强,难度中等.

练习册系列答案
相关题目
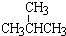 和
和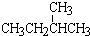 ; ②
; ② 和
和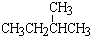 ;
;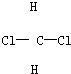 和
和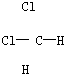

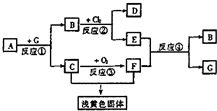 如下图为黑色固体化合物A(FeS)及其产物的一系列反应的框图,每一个方框表示有一种反应物或生成物(反应条件及反应所需和产生的水均略去),其中A、G为反应物,C、F在常温下均为气体.(已知:FeS+2H+=Fe2++H2S↑)
如下图为黑色固体化合物A(FeS)及其产物的一系列反应的框图,每一个方框表示有一种反应物或生成物(反应条件及反应所需和产生的水均略去),其中A、G为反应物,C、F在常温下均为气体.(已知:FeS+2H+=Fe2++H2S↑)