题目内容
6.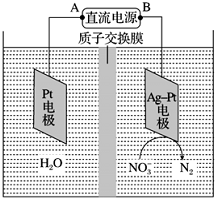 电化学降解NO3-的原理如图所示.
电化学降解NO3-的原理如图所示.①电源A极为正极(填“正极”或“负极”),阴极反应式为2NO3-+10e-+12H+=6H2O+N2↑.
②若电解过程中转移了1mol电子,则膜左侧电解液的质量减少量为9g.
分析 ①根据图象知,硝酸根离子得电子发生氧化反应,则Ag-Pt作阴极,Pt电极为阳极,A为正极,B为负极,以此解答该题;
②由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极,转移1mol电子时,计算阳极上消耗的水的量以及进入阴极室的阳离子的量,进而计算质量的变化.
解答 解:由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极,在阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有H2O参与反应且有水生成,所以阴极上发生的电极反应式为:2NO3-+12H++10e-=N2+6H2O,
故答案为:正极;2NO3-+10e-+12H+=6H2O+N2↑;
②由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极,转移1mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗0.5mol水,产生1molH+进入阴极室,阳极室质量减少9g.
故答案为:9.
点评 本题考查了电解原理,明确阴阳极上发生的电极反应及离子移动方向、阴阳极的判断方法等知识点即可解答,难点是电极反应式的书写,难度中等.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
16.如图为铜铁原电池示意图,下列有关说法正确的是( )
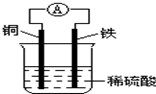

| A. | 铜棒逐渐溶解 | |
| B. | 该装置能将电能转化为化学能 | |
| C. | 负极反应式为Fe-2e-=Fe2+,发生还原反应 | |
| D. | 电子由铁棒通过导线流向铜棒 |
17.下列有关实验的叙述对应关系不正确的是( )
| 选项 | A | B | C | D |
| 装 置 图 |  | 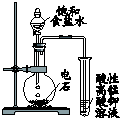 | 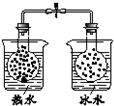 |  |
| 现 象 | 导管中液面上升 | KMnO4溶液褪色 | 热水中的NO2球红棕色加深 | 白色沉淀逐渐转化为黄色沉淀 |
| 结 论 | 该条件下,铁钉发生吸氧腐蚀 | 电石和水反应生成乙炔 | 2NO2(g)?N2O4(g)△H<0 | Ksp:AgCl>AgI |
| A. | A | B. | B | C. | C | D. | D |
14. 利用如图所示装置进行下列实验,实验现象与结论均正确的是( )
利用如图所示装置进行下列实验,实验现象与结论均正确的是( )
 利用如图所示装置进行下列实验,实验现象与结论均正确的是( )
利用如图所示装置进行下列实验,实验现象与结论均正确的是( )| 选项 | 实验试剂 | 实验现象 | 实验结论 | ||
| a | b | c | |||
| A | 浓氨水 | 碱石灰 | FeCl2溶液 | 产生白色沉淀,迅速变为灰绿色,最后变为红褐色 | 氨气具有氧化性 |
| B | 稀硫酸 | FeS | AgCl悬浊液 | 悬浊液由白色变为黑色 | Ksp(AgCl)>Ksp(Ag2S) |
| C | 浓硝酸 | 铜 | BaSO3悬浊液 | 悬浊液变澄清 | +4价硫具有还原性 |
| D | 浓盐酸 | KMnO4 | 紫色石蕊试液 | 溶液先变红后褪色 | Cl2有酸性和漂白性 |
| A. | A | B. | B | C. | C | D. | D |
11.原子序数依次增大的X、Y、Z、M、W为五种短周期元素,已知Y与Z、M与W分别同周期,X与M同主族;X与Z、M与Z都可以分别形成A2B、A2B2型的化合物;X与Y形成的气态化合物在标准状况下的密度为0.76g•L-1;Y、M、W的最高价氧化物的水化物,两两间都能发生反应.下列说法不正确的是( )
| A. | 由X、Y、Z三种元素形成的某种化合物,可能含有离子键 | |
| B. | 五种元素分别形成的单核离子中,M的离子半径最大 | |
| C. | W的氯化物是由一种10e-离子和一种18e-离子构成的 | |
| D. | X元素与Z所在主族的各元素形成的A2B型化合物中X2Z沸点最低 |
15.已知氮原子的质量数为14,则在NH3D+中,电子数、质子数、中子数之比为( )
| A. | 10:7:11 | B. | 11:11:8 | C. | 11:10:8 | D. | 10:11:8 |
 CO(g)+3H2(g)△H=-(a+b-3C)kJ.mol-1.
CO(g)+3H2(g)△H=-(a+b-3C)kJ.mol-1.
 “酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们可以用如图所示的装置制取乙酸乙酯:
“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们可以用如图所示的装置制取乙酸乙酯: