题目内容
16.在体积固定的密闭容器中,发生2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)反应,下列叙述能说明该反应达到化学平衡状态的是( )| A. | 混合气体的密度不变 | B. | 混合气体的平均相对分子质量不变 | ||
| C. | v正(CO)=2v逆(H2) | D. | CO(g)、CH3CH2OH(g)的分子数之比为2:1 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.
解答 解:A、混合气体的密度始终不变,故A错误;
B、混合气体的平均相对分子质量不变,说明气体的总物质的量不变,反应达平衡状态,故B正确;
C、当体系达平衡状态时,2v正(CO)=v逆(H2),故C错误;
D、当体系达平衡状态时,CO(g)、CH3CH2OH(g)的分子数之比可能为2:1,也可能不是2:1,与各物质的初始浓度及转化率有关,故D错误;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
6.FeS2与HNO3反应后的氧化产物为Fe(NO3)3 和H2SO4,若反应中FeS2与HNO3的物质的量之比为1:8,HNO3的还原产物为( )
| A. | NO2 | B. | NO | C. | N2 O | D. | N2O3 |
7.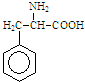 某有机物结构简式如图.一定条件下,该物质与甘氨酸(NH2-CH2-COOH)混合发生反应生成的链状二肽有( )
某有机物结构简式如图.一定条件下,该物质与甘氨酸(NH2-CH2-COOH)混合发生反应生成的链状二肽有( )
 某有机物结构简式如图.一定条件下,该物质与甘氨酸(NH2-CH2-COOH)混合发生反应生成的链状二肽有( )
某有机物结构简式如图.一定条件下,该物质与甘氨酸(NH2-CH2-COOH)混合发生反应生成的链状二肽有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
4.元素周期表短周期的一部分如图所示.下列有关A、B、C、D、E五种元素的叙述中,正确的是( )
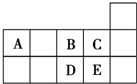

| A. | D在过量的B中燃烧的主要产物为DB3 | |
| B. | C的氢化物的水溶液酸性比E的强 | |
| C. | A与B形成的阴离子可能有AB32-、A2B42- | |
| D. | 原子半径:A>B>C |
11.下列有关金属腐蚀的说法错误的是( )
| A. | 为保护地下钢管不受腐蚀,可使它与锌板或直流电源正极相连 | |
| B. | 在盛水的铁器中,空气与水交界处更容易锈蚀 | |
| C. | 为防止金属的腐蚀可在金属表面涂油漆或油脂 | |
| D. | 纯银器表面在空气中因化学腐蚀渐渐变暗 |
8.下列说法正确的是( )
| A. | 化学电池中电子由正极流出,经外电路流向负极 | |
| B. | 燃料电池两极板均发生氧化还原反应 | |
| C. | 燃料电池工作时,通常是将空气通向正极 | |
| D. | 化学电池的放电过程就是电能转化为化学能的过程 |
5.已知水的电离方程式:H2O?H++OH-.下列叙述中,正确的是( )
| A. | 升高温度,KW增大,pH不变 | |
| B. | 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 | |
| C. | 向水中加入少量硫酸氢钠固体,平衡向逆反应方向移动,c(H+)增大,KW不变 | |
| D. | 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低 |
6.下列物质中既能导电,又属于电解质的是( )
| A. | 氯化钠溶液 | B. | 金属铜 | C. | 熔融硫酸钠 | D. | 氯化氢气体 |