题目内容
6.下列物质中既能导电,又属于电解质的是( )| A. | 氯化钠溶液 | B. | 金属铜 | C. | 熔融硫酸钠 | D. | 氯化氢气体 |
分析 电解质是水溶液中或熔融状态下都导电的化合物,物质导电的条件:存在自由电子或者自由移动的离子,据此解答.
解答 解:A.氯化钠溶液是混合物,既不是电解质也不是非电解质,故A不选;
B.铜是单质,既不是电解质也不是非电解质,故B不选;
C.熔融的硫酸钠,本身能够电离产生自由移动离子而导电,属于电解质,故C选;
D.氯化氢气体不能导电,是电解质,故D不选,
故选C.
点评 本题考查了电解质的判断,熟悉电解质的概念是解题关键,注意电解质一定是化合物,单质、混合物既不是电解质,也不是非电解质.

练习册系列答案
相关题目
16.在体积固定的密闭容器中,发生2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)反应,下列叙述能说明该反应达到化学平衡状态的是( )
| A. | 混合气体的密度不变 | B. | 混合气体的平均相对分子质量不变 | ||
| C. | v正(CO)=2v逆(H2) | D. | CO(g)、CH3CH2OH(g)的分子数之比为2:1 |
17.若NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | NA个二氧化碳分子和0.5mol甲烷的质量比为11:4 | |
| B. | 1molCl2作为氧化剂得到的电子数为NA | |
| C. | 在0℃,101kPa时,11.2L氢气中含有0.5NA个氢原子 | |
| D. | 14g氮气中含有7NA个电子 |
1.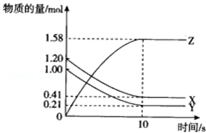 一定温度下,在10L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的( )
一定温度下,在10L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的( )
 一定温度下,在10L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的( )
一定温度下,在10L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的( )| A. | 反应开始10s时,X的物质的量浓度减少了0.79mol•L-1 | |
| B. | 反应的化学方程式为:2X(g)+2Y(g)═3Z(g) | |
| C. | 反应开始到10s时,已用去的Y占起始量的百分比21% | |
| D. | 反应进行到10s时已达到了平衡状态 |
11.“类推”的思维方式在化学学习与研究中经常用到,但有时产生错误的结论.下列类推结论正确的是( )
| A. | 由氢氟酸刻蚀玻璃可推知盐酸也能用来刻蚀玻璃 | |
| B. | 由Na20中阴阳离子个数比为1:2,可推知Na202中阴阳离子个数比为1:1 | |
| C. | 由铁和溴反应生成溴化铁,可推知铁和碘单质反应生成碘化铁 | |
| D. | 由钠与冷水剧烈反应,可推知钾也能与冷水剧烈反应 |
18.下列离子反应方程式中,属于水解反应的是( )
| A. | NH4++H2O?NH3•H2O+H+ | B. | NH3•H2O?NH4++OH- | ||
| C. | HCO3-+H2O?H3O++CO32- | D. | 2Na2O2+2H2O═4NaOH+O2↑ |
16.1923年以前,甲醇一般是用木材或其废料的分解蒸馏来生产的.现在工业上合成甲醇几乎全部采用一氧化碳或二氧化碳加压催化加氢的方法,工艺过程包括造气、合成净化、甲醇合成和粗甲醇精馏等工序.
已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”或“=”).
据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).

(3)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,则曲线Ⅰ可变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积(快速)压缩至2L.
(4)甲醇燃料电池有着广泛的用途,若采用铂为电极材料,两极上分别通入甲醇和氧气,以氢氧化钾溶液为电解质溶液,则该碱性燃料电池的负极反应式是CH3OH-6e-+8OH-=CO32-+6H2O.
已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②2H2(g)+CO2(g)?H2O+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”或“=”).
据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).

(3)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,则曲线Ⅰ可变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积(快速)压缩至2L.
(4)甲醇燃料电池有着广泛的用途,若采用铂为电极材料,两极上分别通入甲醇和氧气,以氢氧化钾溶液为电解质溶液,则该碱性燃料电池的负极反应式是CH3OH-6e-+8OH-=CO32-+6H2O.
