题目内容
4.元素周期表短周期的一部分如图所示.下列有关A、B、C、D、E五种元素的叙述中,正确的是( )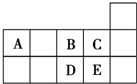
| A. | D在过量的B中燃烧的主要产物为DB3 | |
| B. | C的氢化物的水溶液酸性比E的强 | |
| C. | A与B形成的阴离子可能有AB32-、A2B42- | |
| D. | 原子半径:A>B>C |
分析 由A、B、C、D、E五种元素在短周期中的相对位置可知,A为碳元素,B为氧元素,C为氟元素,D为硫元素,E为氯元素.
A.硫在氧气中燃烧生成二氧化硫;
B.氢氟酸为弱酸,盐酸为强酸;
C.碳元素与氧元素可以形成碳酸根与草酸根离子;
D.同周期自左而右原子半径减小.
解答 解:由A、B、C、D、E五种元素在短周期中的相对位置可知,A为碳元素,B为氧元素,C为氟元素,D为硫元素,E为氯元素.
A.硫在氧气中燃烧生成二氧化硫,不能生成三氧化硫,二氧化硫在催化剂、加热条件下生成三氧化硫,故A错误;
B.氢氟酸为弱酸,盐酸为强酸,盐酸酸性更强,故B错误;
C.碳元素与氧元素可以形成碳酸根离子(CO32-)、草酸根离子C2O42-,故C正确;
D.同周期自左而右原子半径减小,故原子半径A>B>C,故D正确,
故选:CD.
点评 本题考查元素周期表与元素周期律,难度不大,注意基础知识与元素周期表的掌握,C选项为易错点,学生容易忽略草酸根离子.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.修正液(俗称涂改液)白色纯正、反射率高且使用方便,复印时常用于对文稿的修改.目前有许多中小学生使用修正液,用于修改笔记、作业等.由于修正液中含有挥发性的有毒溶剂,教师应告诫学生不要使用.修正液中所含的有毒成分可能是( )
| A. | 乙醇 | B. | 醋酸 | C. | 一氯甲烷 | D. | 三氯乙烯 |
15.下列有关金属及其化合物的说法正确的是( )
| A. | MgO和Al2O3均只能与酸反应,不能与碱反应 | |
| B. | Na和Fe在一定条件下与水反应都生成H2和对应的碱 | |
| C. | Mg和Al都可以用电解法冶炼得到 | |
| D. | Na2O和Na2O2与CO2反应产物相同 |
12.将物质的量共为a mol的NaNO3、Cu(NO3)2和AgNO3的固体混合物用酒精灯加热至恒重,收集到的气体再用足量的水吸收,剩余气体为b mol,则b可能为( )
| A. | 0 | B. | 0.25a | C. | 0.45a | D. | 0.50a |
9.空气中SO2含量是重要的空气质量指标.
ⅰ、某工厂SO2的排放量规定不得超过0.10mg/(L烟道气),为测定该工厂排放的烟道气中SO2的含量,某同学某次抽取了30.00L烟道气缓慢通过1L水,设SO2完全被吸收,设溶液体积为1L,用1.0×10-3mol/L的饱和碘水(密度为1g/cm3)滴定,反应为SO2+I2+2H2O═H2SO4+2HI,实验所记录数据如下:
(1)取25.00ml的烟道气的水溶液所用仪器名称是酸式滴定管
(2)滴定终点标志为滴入最后一滴试液时,溶液变为蓝色,并半分钟内不褪色
(3)该厂排放的烟道气中SO2的含量为0.512mg/(L烟道气)
ⅱ、该同学在实验室还验证了SO2能否与BaCl2溶液反应的实验.二氧化硫通入氯化钡溶液中理论上不产生沉淀,但当他把SO2通入装有1mol/LBaCl2溶液的试管中后,出现了白色浑浊物.
(1)该白色浑浊物为BaSO4,产生该现象的原因可能是空气和溶液中氧气把H2SO3氧化成了H2SO4,从而生成BaSO4
(2)为了避免产生沉淀,该同学设计了如下实验装置,
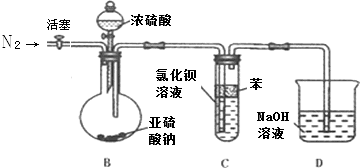
请回答下列问题
①反应开始前,先向制取SO2的装置中通入纯净的N2,其作用是:赶出装置中的气体,防止二氧化硫通入氯化钡溶液后的现象受到空气和溶液中氧气的影响.
②该同学认为Ba(NO3)2溶液与BaCl2溶液一样在理论上与SO2也不会反应,请先判断正误错误(填“正确”、“错误”),如不正确则写出SO2与Ba(NO3)2溶液反应的化学方程式Ba(NO3)2+3SO2+2H2O=BaSO4↓+2NO+2H2SO4.
ⅰ、某工厂SO2的排放量规定不得超过0.10mg/(L烟道气),为测定该工厂排放的烟道气中SO2的含量,某同学某次抽取了30.00L烟道气缓慢通过1L水,设SO2完全被吸收,设溶液体积为1L,用1.0×10-3mol/L的饱和碘水(密度为1g/cm3)滴定,反应为SO2+I2+2H2O═H2SO4+2HI,实验所记录数据如下:
| 溶有SO2的溶液体积 | 饱和碘水体积 | 指示剂 | |
| 第一次 | 25.00mL | 6.05 | 2~3滴淀粉 |
| 第二次 | 25.00mL | 7.20 | 2~3滴淀粉 |
| 第三次 | 25.00mL | 5.95 | 2~3滴淀粉 |
(2)滴定终点标志为滴入最后一滴试液时,溶液变为蓝色,并半分钟内不褪色
(3)该厂排放的烟道气中SO2的含量为0.512mg/(L烟道气)
ⅱ、该同学在实验室还验证了SO2能否与BaCl2溶液反应的实验.二氧化硫通入氯化钡溶液中理论上不产生沉淀,但当他把SO2通入装有1mol/LBaCl2溶液的试管中后,出现了白色浑浊物.
(1)该白色浑浊物为BaSO4,产生该现象的原因可能是空气和溶液中氧气把H2SO3氧化成了H2SO4,从而生成BaSO4
(2)为了避免产生沉淀,该同学设计了如下实验装置,

请回答下列问题
①反应开始前,先向制取SO2的装置中通入纯净的N2,其作用是:赶出装置中的气体,防止二氧化硫通入氯化钡溶液后的现象受到空气和溶液中氧气的影响.
②该同学认为Ba(NO3)2溶液与BaCl2溶液一样在理论上与SO2也不会反应,请先判断正误错误(填“正确”、“错误”),如不正确则写出SO2与Ba(NO3)2溶液反应的化学方程式Ba(NO3)2+3SO2+2H2O=BaSO4↓+2NO+2H2SO4.
16.在体积固定的密闭容器中,发生2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)反应,下列叙述能说明该反应达到化学平衡状态的是( )
| A. | 混合气体的密度不变 | B. | 混合气体的平均相对分子质量不变 | ||
| C. | v正(CO)=2v逆(H2) | D. | CO(g)、CH3CH2OH(g)的分子数之比为2:1 |