题目内容
1.(1)N2(g)+3H2(g)?2NH3(g)△H=-94.4kJ•mol-l.恒容时体系中各物质浓度随时间变化的曲线如图1所示,20min时达平衡状态.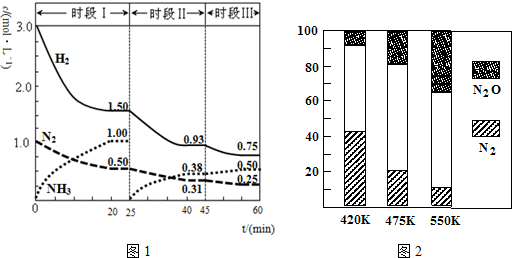
①在1L容器中发生反应,前20min内,v(NH3)=0.050mol(L•min)-1,放出的热量为47.2kJ;
②25min时采取的措施是将NH3从反应体系中分离出去;
③时段Ⅲ条件下,反应平衡常数表达式为(用具体数据表示)$\frac{(0.50mol/L)^{2}}{(0.75mol/L)^{3}×0.25mol/L}$.
(2)电厂烟气脱氮的主反应①:4NH3(g)+6NO(g)?5N2(g)+6H2O(g)△H<0,副反应②:2NH3(g)+8NO(g)?5N2O(g)+3H2O(g)△H>0.平衡混合气中N2与N2O含量与温度的关系如图2.平衡混合气中N2含量随温度的变化规律是随温度升高,N2的含量降低,导致这种变化的原因是主反应为放热反应,升温使主反应的平衡左移或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移(答合理的一条原因).
(3)直接供氨式燃料电池是以NaOH溶液为电解质的.电池反应为:4NH3+3O2═2N2+6H2O,则负极电极反应式为2NH3+6OH--6e-=N2+6H2O.
分析 (1)①根据v=$\frac{△c}{△t}$计算出前20min内氨气的平均反应速率v(NH3),根据达到平衡时生成氨气的物质的量及热化学方程式N2(g)+3H2(g)?2NH3(g);△H=-94.4kJ•mol-1计算出放出的热量;
②根据25min时氨气的物质的量变为0,而氮气和氢气的物质的量不变进行解答,改变的条件是分离出氨气;
③根据时段Ⅲ条件下达到平衡时各组分的浓度及平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积进行解答;
(2)根据图2中随着温度升高,氮气、N2O的含量变化进行分析,温度对化学平衡影响及两个可逆反应的反应热情况,升温使主反应的平衡左移或者副反应为吸热反应,升温使副反应的平衡右移;
(3)根据原电池工作原理及电极反应写出该燃料电池的负极反应式,燃料失电子发生氧化反应是负极上的反应,氨气失电子在碱溶液中生成氮气,结合原子守恒和电荷守恒写出电极反应.
解答 解:(1)①根据图象可知,20min时氨气的物质的量浓度为1.00mol/L,所以氨气的平均反应速率为:v(NH3)=$\frac{1.00mol/L}{20min}$=0.050mol(L•min)-1;
达到平衡时生成的氨气的物质的量为:1.00 mol/L×1L=1.00mol,
根据N2(g)+3H2(g)?2NH3(g);△H=-94.4kJ•mol-1可知生成1.00mol氨气放出的热量为$\frac{1}{2}$×94.4kJ•mol-1=47.2kJ,
故答案为:0.050mol(L•min)-1; 47.2kJ;
②25min时氨气的物质的量迅速变为0而氮气、氢气的物质的量不变,之后氮气、氢气的物质的量逐渐减小,氨气的物质的量逐渐增大,说明25min时改变的条件是将NH3从反应体系中分离出去,
故答案为:将NH3从反应体系中分离出去;
③时段Ⅲ条件下,反应为:N2(g)+3H2(g)?2NH3(g),图象方向可知平衡状态下[N2]=0.25mol/L,[NH3]=0.50mol/L,[H2]=0.75mol/L,该反应的化学平衡常数为:K=$\frac{[N{H}_{3}]^{2}}{[{H}_{2}]^{3}[{N}_{2}]}$=$\frac{(0.50mol/L)^{2}}{(0.75mol/L)^{3}×0.25mol/L}$,
故答案为:$\frac{(0.50mol/L)^{2}}{(0.75mol/L)^{3}×0.25mol/L}$;
(2)根据图象可知,在400K~600K时,平衡混合气中N2含量随温度的升高逐渐降低,主反应为放热反应,升高温度,平衡向着逆向移动,氮气的含量减小或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移,
故答案为:随温度升高,N2的含量降低;主反应为放热反应,升温使主反应的平衡左移或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移;
(3)原电池负极失去电子发生氧化反应,所以该燃料电池中负极氨气失去电子生成氮气,碱性环境下生成氮气和水,电极反应式为2NH3+6OH--6e-=N2+6H2O,
故答案为:2NH3+6OH--6e-=N2+6H2O.
点评 本题考查了化学反应速率计算、影响化学平衡的因素及原电池工作原理,题目难度中等,注意掌握温度等因素对化学平衡的影响,原电池电极书写方法,明确化学反应速率、化学平衡常数的概念及计算方法是解题关键.

| A. | 0 | B. | 0.25a | C. | 0.45a | D. | 0.50a |
ⅰ、某工厂SO2的排放量规定不得超过0.10mg/(L烟道气),为测定该工厂排放的烟道气中SO2的含量,某同学某次抽取了30.00L烟道气缓慢通过1L水,设SO2完全被吸收,设溶液体积为1L,用1.0×10-3mol/L的饱和碘水(密度为1g/cm3)滴定,反应为SO2+I2+2H2O═H2SO4+2HI,实验所记录数据如下:
| 溶有SO2的溶液体积 | 饱和碘水体积 | 指示剂 | |
| 第一次 | 25.00mL | 6.05 | 2~3滴淀粉 |
| 第二次 | 25.00mL | 7.20 | 2~3滴淀粉 |
| 第三次 | 25.00mL | 5.95 | 2~3滴淀粉 |
(2)滴定终点标志为滴入最后一滴试液时,溶液变为蓝色,并半分钟内不褪色
(3)该厂排放的烟道气中SO2的含量为0.512mg/(L烟道气)
ⅱ、该同学在实验室还验证了SO2能否与BaCl2溶液反应的实验.二氧化硫通入氯化钡溶液中理论上不产生沉淀,但当他把SO2通入装有1mol/LBaCl2溶液的试管中后,出现了白色浑浊物.
(1)该白色浑浊物为BaSO4,产生该现象的原因可能是空气和溶液中氧气把H2SO3氧化成了H2SO4,从而生成BaSO4
(2)为了避免产生沉淀,该同学设计了如下实验装置,
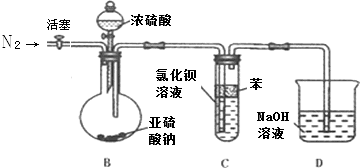
请回答下列问题
①反应开始前,先向制取SO2的装置中通入纯净的N2,其作用是:赶出装置中的气体,防止二氧化硫通入氯化钡溶液后的现象受到空气和溶液中氧气的影响.
②该同学认为Ba(NO3)2溶液与BaCl2溶液一样在理论上与SO2也不会反应,请先判断正误错误(填“正确”、“错误”),如不正确则写出SO2与Ba(NO3)2溶液反应的化学方程式Ba(NO3)2+3SO2+2H2O=BaSO4↓+2NO+2H2SO4.
| A. | 混合气体的密度不变 | B. | 混合气体的平均相对分子质量不变 | ||
| C. | v正(CO)=2v逆(H2) | D. | CO(g)、CH3CH2OH(g)的分子数之比为2:1 |
| A. | 1H和3H是不同的核素 | |
| B. | 1H、2H、3H、H+和H2是氢元素的五种不同粒子 | |
| C. | 12C和14C互为同位素,物理性质不同,但化学性质几乎完全相同 | |
| D. | 石墨和金刚石互为同位素,化学性质相似 |
| A. | 由氢氟酸刻蚀玻璃可推知盐酸也能用来刻蚀玻璃 | |
| B. | 由Na20中阴阳离子个数比为1:2,可推知Na202中阴阳离子个数比为1:1 | |
| C. | 由铁和溴反应生成溴化铁,可推知铁和碘单质反应生成碘化铁 | |
| D. | 由钠与冷水剧烈反应,可推知钾也能与冷水剧烈反应 |
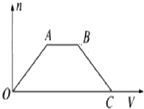 将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系如图,图中AB段表示的离子方程式是( )
将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系如图,图中AB段表示的离子方程式是( )