题目内容
5. 为某有机物与H2发生加成反应后的产物,符合该条件的稳定有机物物共有( )[已知
为某有机物与H2发生加成反应后的产物,符合该条件的稳定有机物物共有( )[已知  是不稳定的].
是不稳定的].| A. | 2 种 | B. | 3种 | C. | 1种 | D. | 4种 |
分析 此有机物为醇,由于是与H2发生加成反应后的产物,故可能为-CHO与氢气加成、烯醇与氢气加成、烯醛与氢气加成,据此分析.
解答 解:此有机物为醇,由于是与H2发生加成反应后的产物,故可能为-CHO与氢气加成、烯醇与氢气加成、烯醛与氢气加成得来,故符合条件的稳定的有机物的结构简式有三种可能,分别是 、
、 和
和 ,
,
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机物的结构等为解答的关键,侧重分析与应用能力的综合考查,题目难度中等.

练习册系列答案
相关题目
15.下列有关Na2CO3 和NaHCO3的说法错误的是( )
| A. | 等质量Na2CO3 和NaHCO3分别和足量盐酸反应,相同条件下前者生成CO2少 | |
| B. | 将石灰水分别加入NaHCO3和Na2CO3 中,前者不生成沉淀 | |
| C. | 相同条件下Na2CO3 比NaHCO3更易溶于水 | |
| D. | Na2CO3 固体中含少量NaHCO3,可用加热法除去 |
16.下列有关叙述正确的是( )
| A. | 合成氨生产中将NH3液化分离,一定能加快正反应速率,提高H2的转化率 | |
| B. | 已知2H2(g)+O2(g)═2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol | |
| C. | CH3Cl(g)+Cl2(g)$\stackrel{光照}{→}$CH2Cl2(l)+HCl(g)能自发进行,则该反应的△H>0 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g);△H1,2C(s)+O2(g)═2CO(g);△H2.则△H1<△H2 |
13.一定条件下,在体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)═Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是( )
| A. | 若增大压强,平衡向正方向移动,平衡常数变大 | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为0.015mol/L | |
| C. | 达到平衡时X浓度为0.04 mol/L | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H>0 |
20. 碳及其化合物有广泛的用途.
碳及其化合物有广泛的用途.
(1)甲醇常作燃料,已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1
②2CO(g)+O2(g)=2CO2(g)△H2
③H2O(g)=H2O(l)△H3
则1mol 甲醇不完全燃烧生成一氧化碳和液态水时反应的△H=$\frac{1}{2}$(△H1-△H2+4△H3)kJ•mol-1.(用含△H1、△H2、△H3的式子表示)
(2)煤的综合利用煤气化是将水蒸气通过红热的碳可产生水煤气:
C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol,达到平衡后,能提高水煤气的生成速率的措施是AC.
A.升高温度 B.增加碳的用量 C.缩小体积 D.用CO吸收剂除去CO
(3)将一定量的C (s)和H2O(g)通过某恒容的密闭容器中发生反应,得到如下数据:
通过计算,该反应的平衡常数为:0.25.
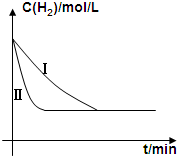
(4)工业上用水煤气来合成有机燃料,例如:CO(g)+2H2(g)$\stackrel{一定条件下}{?}$CH3OH(g)△H=-91kJ/mol某同学在不同实验条件下模拟化工生产进行实验,H2浓度随时间变化如图:
①实验I比实验II达到平衡所用的时间长.(填“长”“短”或“相等”)
②实验III比实验I的温度要高,其它条件相同,请在上图画出实验I和实验III中H2浓度随时间变化的示意图.
 碳及其化合物有广泛的用途.
碳及其化合物有广泛的用途.(1)甲醇常作燃料,已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1
②2CO(g)+O2(g)=2CO2(g)△H2
③H2O(g)=H2O(l)△H3
则1mol 甲醇不完全燃烧生成一氧化碳和液态水时反应的△H=$\frac{1}{2}$(△H1-△H2+4△H3)kJ•mol-1.(用含△H1、△H2、△H3的式子表示)
(2)煤的综合利用煤气化是将水蒸气通过红热的碳可产生水煤气:
C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol,达到平衡后,能提高水煤气的生成速率的措施是AC.
A.升高温度 B.增加碳的用量 C.缩小体积 D.用CO吸收剂除去CO
(3)将一定量的C (s)和H2O(g)通过某恒容的密闭容器中发生反应,得到如下数据:
| 温度/℃ | 起始浓度mol/L | 平衡浓度mol/L | |
| CO(g) | H2O(g) | H2(g) | |
| 900 | 2.0 | 0.8 | 0.4 |
(4)工业上用水煤气来合成有机燃料,例如:CO(g)+2H2(g)$\stackrel{一定条件下}{?}$CH3OH(g)△H=-91kJ/mol某同学在不同实验条件下模拟化工生产进行实验,H2浓度随时间变化如图:
①实验I比实验II达到平衡所用的时间长.(填“长”“短”或“相等”)
②实验III比实验I的温度要高,其它条件相同,请在上图画出实验I和实验III中H2浓度随时间变化的示意图.
17.在一定温度下将1molCO 和3mol 水蒸气放在密闭的容器中发生下列反应CO(g)+H2O(g)?CO2(g)+H2(g)达到平衡后,测得CO2为0.75mol,再通入6mol 水蒸气,达到新的平衡后,CO2和H2的物质的量之和为( )
| A. | 1.2 mol | B. | 1.5 mol | C. | 1.8 mol | D. | 2.1 mol |
14.下列对NO、NO2的描述,不正确的是( )
| A. | NO2是红棕色气体,易溶于水,不是酸性氧化物 | |
| B. | NO可以用排水法收集,但不能由N2和O2直接化合而得到 | |
| C. | NO、NO2在一定条件下可相互转化,且二者都是引起光化学烟雾的大气污染物 | |
| D. | NO、NO2都有毒,且NO是汽车尾气的有害成分之一 |
15.常温下易溶于水,在一定条件下又能与水反应的是( )
| A. | 蔗糖 | B. | 氯乙烷 | C. | 植物油 | D. | 葡萄糖 |
 .
.