题目内容
15.下列有关Na2CO3 和NaHCO3的说法错误的是( )| A. | 等质量Na2CO3 和NaHCO3分别和足量盐酸反应,相同条件下前者生成CO2少 | |
| B. | 将石灰水分别加入NaHCO3和Na2CO3 中,前者不生成沉淀 | |
| C. | 相同条件下Na2CO3 比NaHCO3更易溶于水 | |
| D. | Na2CO3 固体中含少量NaHCO3,可用加热法除去 |
分析 A.等质量的Na2CO3和NaHCO3,碳酸钠的摩尔质量大,其物质的量少;
B.Na2CO3和NaHCO3都能与澄清的石灰水反应生成沉淀;
C.相同条件下,碳酸铵的溶解度大于碳酸氢钠的溶解度;
D.NaHCO3不稳定,加热易分解;
解答 解:A.等质量的Na2CO3和NaHCO3,碳酸钠的摩尔质量大,其物质的量少,盐酸足量,碳元素守恒,则与盐酸完全反应碳酸钠产生的气体少,故A正确;
B.Na2CO3和NaHCO3都能与澄清的石灰水反应生成沉淀,反应为CO32-+Ca2+=CaCO3↓,2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-,故B错误;
C.向饱和碳酸钠溶液中通入二氧化碳析出碳酸氢钠晶体,则相同条件下,在水中的溶解性为NaHCO3<Na2CO3,故C正确;
D.NaHCO3不稳定,加热易分解:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,碳酸钠受热稳定,可用加热法除去,故D正确;
故选B.
点评 本题考查碳酸钠和碳酸氢钠性质的比较,为高频考点,把握二者性质的差异是解答的关键,注意知识的积累和灵活应用,题目难度不大.

练习册系列答案
相关题目
5.向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
| 操作 | 现象 | 结论 | |
| A | 滴加AgNO3溶液 | 生成白色沉淀 | 原溶液中有Cl- |
| B | 滴加盐酸溶液 | 产生无色无味气体使澄清石灰水变浑浊 | 原溶液中有CO32- |
| C | 滴加硫酸钠和稀硝酸溶液 | 产生白色沉淀 | 原溶液中有Ba2+ |
| D | 滴加稀NaOH溶液 | 生成白色沉淀 | 原溶液中一定有Mg2+ |
| A. | A | B. | B | C. | C | D. | D |
6.对下列化学用语的理解和描述均正确的是( )
| A. | NH4I的电子式: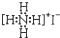 | |
| B. | 填充模型 可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 | |
| C. | 原子结构示意图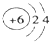 可以表示12C,也可以表示14C 可以表示12C,也可以表示14C | |
| D. | 结构示意图为 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 |
3.如图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图.下列说法正确的是( )
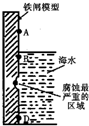

| A. | 该过程发生了析氢腐蚀 | |
| B. | 铁单质被直接氧化生成Fe3+ | |
| C. | B点附近会生成最多的铁锈 | |
| D. | 在铁闸上镶嵌一些铜片可以减缓海水对铁闸的腐蚀 |
10.下列溶液中,与100mL 0.5mol/L NaCl溶液所含的Cl-的物质的量相同的是( )
| A. | 200 mL 0.25 mol/L CaCl2溶液 | B. | 100 mL 0.25 mol/L HCl溶液 | ||
| C. | 50 mL 1mol/L NaCl溶液 | D. | 100 mL 0.5 mol/L MgCl2 溶液 |
20.已知常温下Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5×10-13,下列有关说法错误的是( )
| A. | 在饱和AgCl,AgBr的混合溶液中:$\frac{c(C{l}^{-})}{c(B{r}^{-})}$=360 | |
| B. | 向AgCl悬浊液中滴加NaBr溶液会产生淡黄色沉淀 | |
| C. | AgCl在水中溶解度及Ksp均比在NaCl溶液中的大 | |
| D. | 欲用1L NaCl溶液将0.01 mol AgBr转化为AgCl,则c(NaCl)>3.61 mol/L |
4.已建立化学平衡的某可逆反应,当改变条件使平衡向正反应方向移动,正确的是( )
| A. | 生成物的百分含量一定增加 | B. | 正反应速率大于逆反应速率 | ||
| C. | 反应物的转化率一定增大 | D. | 反应物浓度一定降低 |
5. 为某有机物与H2发生加成反应后的产物,符合该条件的稳定有机物物共有( )[已知
为某有机物与H2发生加成反应后的产物,符合该条件的稳定有机物物共有( )[已知  是不稳定的].
是不稳定的].
 为某有机物与H2发生加成反应后的产物,符合该条件的稳定有机物物共有( )[已知
为某有机物与H2发生加成反应后的产物,符合该条件的稳定有机物物共有( )[已知  是不稳定的].
是不稳定的].| A. | 2 种 | B. | 3种 | C. | 1种 | D. | 4种 |