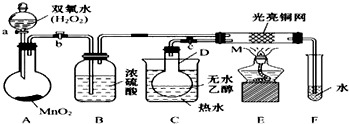
题目内容
20. 碳及其化合物有广泛的用途.
碳及其化合物有广泛的用途.(1)甲醇常作燃料,已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1
②2CO(g)+O2(g)=2CO2(g)△H2
③H2O(g)=H2O(l)△H3
则1mol 甲醇不完全燃烧生成一氧化碳和液态水时反应的△H=$\frac{1}{2}$(△H1-△H2+4△H3)kJ•mol-1.(用含△H1、△H2、△H3的式子表示)
(2)煤的综合利用煤气化是将水蒸气通过红热的碳可产生水煤气:
C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol,达到平衡后,能提高水煤气的生成速率的措施是AC.
A.升高温度 B.增加碳的用量 C.缩小体积 D.用CO吸收剂除去CO
(3)将一定量的C (s)和H2O(g)通过某恒容的密闭容器中发生反应,得到如下数据:
| 温度/℃ | 起始浓度mol/L | 平衡浓度mol/L | |
| CO(g) | H2O(g) | H2(g) | |
| 900 | 2.0 | 0.8 | 0.4 |
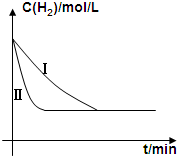
(4)工业上用水煤气来合成有机燃料,例如:CO(g)+2H2(g)$\stackrel{一定条件下}{?}$CH3OH(g)△H=-91kJ/mol某同学在不同实验条件下模拟化工生产进行实验,H2浓度随时间变化如图:
①实验I比实验II达到平衡所用的时间长.(填“长”“短”或“相等”)
②实验III比实验I的温度要高,其它条件相同,请在上图画出实验I和实验III中H2浓度随时间变化的示意图.
分析 (1)根据盖斯定律,将已知反应(①-②-③×4)×$\frac{1}{2}$得到CH3OH(l)+O2(g)=CO(g)+2H2O(l),据此回答;
(2)能提高水煤气的生成速率的措施可以是升高温度,增加压强,增加物质的浓度等;
(3)计算出各物质的平衡浓度,结合平衡常数的表达式计算;
(4)①与实验Ⅰ比较,实验Ⅱ达到平衡时间长;
②正反应放热,升高温度平衡向逆反应方向移动,氨气的转化率减小.
解答 解:(1)根据盖斯定律,将已知反应(①-②-③×4)×$\frac{1}{2}$得到CH3OH(l)+O2(g)=CO(g)+2H2O(l),所以该反应的△H=$\frac{1}{2}$(△H1-△H2+4△H3)kJ•mol-1,故答案为:$\frac{1}{2}$(△H1-△H2+4△H3)kJ•mol-1;
(2)A.升高温度可以加快反应速率,故A正确;
B.碳是固体,增加碳的用量不会引起反应速率的变化,故B错误;
C.缩小体积即增加压强,可以加快反应速率,故C正确;
D.用CO吸收剂除去CO可以减慢反应速率,故D错误,
故选AC;
(3)CO(g)+H2O(g)?CO2(g)+H2(g)
起始(mol/L) 2.0 0.8 0 0
转化(mol/L) 0.4 0.4 0.4 0.4
平衡(mol/L) 1.6 0.4 0.4 0.4
K=$\frac{0.4×0.4}{1.6×0.4}$=0.25,故答案为:0.25;
(4)①与实验Ⅰ比较,实验Ⅱ达到平衡时间长,故答案为:长;
②正反应放热,升高温度反应速率加快,平衡向逆反应方向移动,氢气的平浓度增大,图象为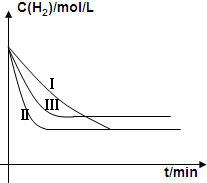 ,故答案为:
,故答案为: .
.
点评 本题考查较为综合,涉及盖斯定律的计算、化学反应速率的影响因素、化学平衡问题,侧重于学生的分析能力和计算能力的考查,为高频考点,注意把握化学平衡常数的应用以及平衡移动的影响因素,难度中等.

| A. | 200 mL 0.25 mol/L CaCl2溶液 | B. | 100 mL 0.25 mol/L HCl溶液 | ||
| C. | 50 mL 1mol/L NaCl溶液 | D. | 100 mL 0.5 mol/L MgCl2 溶液 |
| A. | 石油的炼制过程不都是化学变化 | |
| B. | 煤中含有苯和甲苯,可用蒸馏的方法将它们分离 | |
| C. | 煤是工业上获得芳香烃的一种重要原料 | |
| D. | 煤通过液化和气化处理能减少环境污染 |
 为某有机物与H2发生加成反应后的产物,符合该条件的稳定有机物物共有( )[已知
为某有机物与H2发生加成反应后的产物,符合该条件的稳定有机物物共有( )[已知  是不稳定的].
是不稳定的].| A. | 2 种 | B. | 3种 | C. | 1种 | D. | 4种 |
| A. | 绿色化学的核心就是利用化学原理减少和消除工业生产对环境的污染 | |
| B. | 石油是由多种碳氢化合物组成的混合物 | |
| C. | 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 | |
| D. | 煤的干馏是将煤隔绝空气加强热使之分解的过程 |
| A. | KOH | B. | Na2SO4 | C. | CO2 | D. | HCl |
| A. | 乙醇、乙二醇 | B. | 丙醇、丁醇 | C. | 丙醇、丙烯 | D. | 丁醇、乙醛 |