题目内容
9.下列关于热化学反应的描述中正确的是( )| A. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=-114.6kJ/mol | |
| B. | 由4P(s,红磷)=P4(s,白磷):△H>0可知,白磷的热稳定性比红磷大 | |
| C. | 己知:S(g)+O2(g)=SO2(g);△H1及S(s)+O2(g)=SO2(g):△H2,则△H1<△H2 | |
| D. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 |
分析 A.中和热是指在稀溶液中,强酸和强碱反应生成1mol水时所放出的热量;
B.物质具有的能量越高,其稳定性越弱,结合该反应为吸热反应分析;
C.气态硫具有的能量较高,则前者放出的热量较大,结合焓变为负值分析;
D.燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,C元素转化为二氧化碳,氢元素转化为液态水;
解答 解:A.中和热与生成水的物质的量多少无关,则H2SO4和Ca(OH)2反应的中和热△H=-57.3kJ•mol-1,由于反应生成硫酸钙沉淀,则硫酸与氢氧化钙的反应热△H<-114.6kJ/mol,故A错误;
B.4P(s,红磷)=P4(s,白磷)△H>0,该反应为吸热反应,说明白磷具有的能量较高,则红磷的热稳定性大于白磷,故B错误;
C.反应S(g)+O2(g)=SO2(g)△H1及S(s)+O2(g)=SO2(g)△H2,气态硫具有的能量较高,则前者放出热量较多,由于焓变为负值,则△H1<△H2,故C正确;
D.燃烧热中生成氧化物必须为稳定氧化物,水在液态时较稳定,应该生成液态水,故D错误;
故选C.
点评 本题较为综合,涉及中和热、燃烧热、反应热大小及物质的稳定性的比较,题目难度不大,注意把握燃烧热、中和热的概念,易错点为C,注意放热反应中焓变为负值,放出热量越多,焓变越小.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.用离子交换树脂除去水中的盐类以制取去离子水.应选用( )
| A. | 阳离子交换树脂 | B. | 阴离子交换树脂 | ||
| C. | 阳离子交换树脂和阴离子交换树脂 | D. | 离子交换树脂 |
20.下列说法不正确的是( )
| A. | 形成酸雨的主要物质是硫的氧化物和氮的氧化物 | |
| B. | 海洋元素--溴的提取常用“空气吹出法”,该制备方法中溴元素依次经过被氧化、被还原、被氧化的三过程 | |
| C. | 绿色化学的核心就是如何对被污染的环境进行无毒无害的治理 | |
| D. | 水华、赤潮等水体污染主要是由含氮、磷的生活污水任意排放造成的 |
17.已知0.3mol C在0.2mol O2中燃烧,至反应物耗尽,并放出X kJ热量.已知单质碳的燃烧热为Y kJ/mol,则1mol C与O2反应生成CO的反应热△H为( )
| A. | -Y kJ/mol | B. | -(5X-0.5Y)kJ/mol | C. | -(10X-Y)kJ/mol | D. | +(10X-Y)kJ/mol |
4.下列各组粒子,质子数和电子数都相等的是( )
| A. | NH4+和OH- | B. | HS-与S2- | C. | CO和N2 | D. | H2O2和K+ |
18.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z为地壳中含量最高的金属元素.下列说法正确的是( )
| X | ||||||
| Y | Z | W |
| A. | 工业上电解ZW3饱和溶液冶炼金属Z | |
| B. | 元素X的最高正价与W的最高正价相同 | |
| C. | 简单离子半径的大小顺序:r(X-)<r(Y+) | |
| D. | Y、W的最高价氧化物的水化物均能溶解金属Z |
19.阿伏加德罗常数为 NA,下列说法正确的是( )
| A. | 1 mol 钠与氧气反应生成 Na2O 或 Na2O2时,失电子数目均为 NA | |
| B. | 1 mol/L 的 NaOH 溶液中含 Na+数目为 NA | |
| C. | 标准状况下,2.24LC6H6 所含的分子数目为 0.1NA | |
| D. | 1 mol Na2O2 中含有的阴离子数目为 2NA |
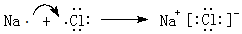 .
.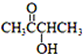 )有如下转化关系,且 1mol B反应生成了2mol C.
)有如下转化关系,且 1mol B反应生成了2mol C.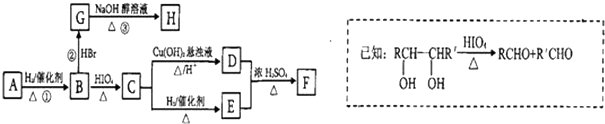
 .
.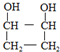 .
.