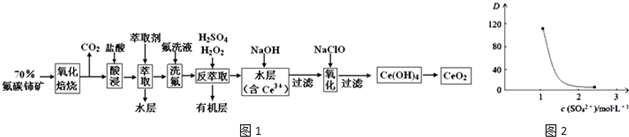
题目内容
17.已知0.3mol C在0.2mol O2中燃烧,至反应物耗尽,并放出X kJ热量.已知单质碳的燃烧热为Y kJ/mol,则1mol C与O2反应生成CO的反应热△H为( )| A. | -Y kJ/mol | B. | -(5X-0.5Y)kJ/mol | C. | -(10X-Y)kJ/mol | D. | +(10X-Y)kJ/mol |
分析 碳在氧气中燃烧,氧气不足发生反应2C+O2$\frac{\underline{\;点燃\;}}{\;}$2CO,氧气足量发生反应C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2,0.3mol C在0.2mol O2中燃烧,介于2:1与1:1之间,所以上述反应都发生;设生成的CO为xmol、CO2为ymol,根据碳元素与氧元素守恒列方程计算x、y的值,计算生成ymol二氧化碳的热量,放出的总热量减去生成二氧化碳,放出的热量为生成xmolCO放出的热量,据此计算1molC与O2反应生成CO的反应热△H.
解答 解:碳在氧气中燃烧,氧气不足发生反应2C+O2$\frac{\underline{\;点燃\;}}{\;}$2CO,氧气足量发生反应C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2,
0.3mol C在0.2mol O2中燃烧,n(C):n(O2)=3:2,介于2:1与1:1之间,则上述反应都发生,
设生成的CO为xmol,CO2为ymol,
根据碳元素守恒有x+y=0.3,根据氧元素守恒有x+2y=0.2×2,联立方程解得:x=0.2、y=0.1,
单质碳的燃烧热为Y kJ/mol,所以生成0.1mol二氧化碳放出的热量为:0.1mol×Y kJ/mol=0.1YkJ,
所以生成0.2molCO放出的热量为:XkJ-0.1YkJ,
由于碳燃烧为放热反应,所以反应热△H的符号为“-”,
所以1mol C与O2反应生成CO的反应热△H=-$\frac{XkJ-0.1YkJ}{0.2mol}$=-(5X-0.5Y)kJ/mol,
故选B.
点评 本题考查反应热的计算,题目难度中等,判断碳与氧气反应产物中一氧化碳与二氧化碳的物质的量是关键,注意反应热△H的单位与符号,容易忽略,试题培养了学生的分析能力及化学计算能力.

 中考解读考点精练系列答案
中考解读考点精练系列答案| A. | 生活污水的任意排放 | B. | 所有绿色植物的光合作用 | ||
| C. | 废电池的随意丢弃 | D. | 化肥和杀虫剂的大量使用 |
| A. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=-114.6kJ/mol | |
| B. | 由4P(s,红磷)=P4(s,白磷):△H>0可知,白磷的热稳定性比红磷大 | |
| C. | 己知:S(g)+O2(g)=SO2(g);△H1及S(s)+O2(g)=SO2(g):△H2,则△H1<△H2 | |
| D. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 |
| A. | 所有自发进行的化学反应都是放热反应 | |
| B. | 熵值增大的反应都能自发进行 | |
| C. | 由能量判据和熵判据组合而成的复合判据,适合于所有的反应 | |
| D. | 同一物质的固、液、气三种状态的熵值相同 |
 东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:
东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题: ,画出表中(3)的微粒结构示意图为
,画出表中(3)的微粒结构示意图为 .
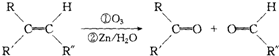
. 
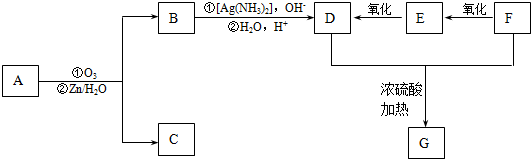
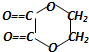 +2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.
+2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.
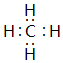 ,上述元素中,能和⑤号元素形成正四面体空间网状结构的化合物的化学式是SiO2.
,上述元素中,能和⑤号元素形成正四面体空间网状结构的化合物的化学式是SiO2.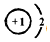 、
、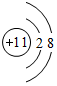 .
.