题目内容
以铁为阳极、以铜为阴极,对足量的NaOH溶液进行电解.一段时间后得到2molFe(OH)3沉淀,此时共消耗的水的物质的量为( )
| A、2 mol |
| B、3 mol |
| C、4 mol |
| D、5 mol |
考点:电解原理
专题:电化学专题
分析:活泼金属铁作电解池阳极时,阳极上阳极材料铁失电子发生氧化反应生成亚铁离子进入溶液,亚铁离子和溶液中的氢氧根离子生成氢氧化亚铁沉淀,氢氧化亚铁不稳定,能被氧气氧化成氢氧化铁沉淀,注意消耗的水有两部分:一部分被电解生成氢气,一部分和氢氧化亚铁反应生成氢氧化铁.
解答:
解:根据铁原子守恒知,2molFe(OH)3→2molFe(OH)2,所以生成2molFe(OH)3需要2molFe(OH)2;
活泼金属铁作电解池阳极时,电解氢氧化钠溶液的电解方程式为Fe+2H2O
H2+Fe(OH)2↓,
根据电解方程式得,生成2molFe(OH)2需要水的物质的量为4mol;
又氢氧化亚铁不稳定,能被氧气氧化成氢氧化铁沉淀,反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
根据方程式得,生成2molFe(OH)3需要水的物质的量为1mol,
所以得到2molFe(OH)3沉淀消耗水的物质的量共为5mol.
故选D.
活泼金属铁作电解池阳极时,电解氢氧化钠溶液的电解方程式为Fe+2H2O
| ||
根据电解方程式得,生成2molFe(OH)2需要水的物质的量为4mol;
又氢氧化亚铁不稳定,能被氧气氧化成氢氧化铁沉淀,反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
根据方程式得,生成2molFe(OH)3需要水的物质的量为1mol,
所以得到2molFe(OH)3沉淀消耗水的物质的量共为5mol.
故选D.
点评:本题考查了电解原理,难度不大,注意:活泼金属作电解池阳极时,活泼金属失电子发生氧化反应,而不是溶液中的阴离子失电子发生氧化反应.

练习册系列答案
相关题目
有关下列图象的说法正确的是( )
A、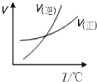 表示的反应速率随温度变化的关系可知该反应的△H>0 |
B、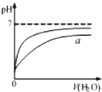 表示向pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,则其中曲线a对应的是醋酸 |
C、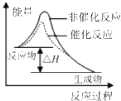 表示该反应为放热反应.且催化剂能降低反应的活化能、改变反应的焓变 |
D、 中开关K置于a或b处均可减缓铁的腐蚀 |
在T℃下,某反应达到平衡,平衡常数K=
.恒容时,温度升高,NO浓度减小.下列说法正确的是( )
| [NO][SO3] |
| [NO2][SO2] |
| A、该反应的焓变为正值 |
| B、恒温下减小压强,反应体系的颜色加深 |
| C、升高温度,逆反应速率减小 |
| D、该反应化学方程式为NO2+SO2?NO+SO3 |
下列物质的沸点由高到低的排列正确的是( )
①丙烷②乙二醇③乙醇④丁烷⑤乙烷⑥2-甲基丙烷.
①丙烷②乙二醇③乙醇④丁烷⑤乙烷⑥2-甲基丙烷.
| A、②③⑥④①⑤ |
| B、②③④⑥①⑤ |
| C、④⑥①②③⑤ |
| D、④①③⑥②⑤ |
已知X、Y是主族元素,I为电离能,单位是kJ?mol-1.请根据下表所列数据判断,下列说法错误的是( )
| 元素 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A、若元素Y处于第三周期,则它可与冷水剧烈反应 |
| B、元素Y是第ⅢA族元素 |
| C、元素X与氯形成化合物时,化学式可能是XCl |
| D、元素X的常见化合价是+1价 |
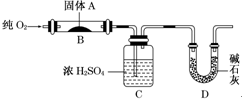 实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图(铁架台、铁夹、酒精灯等未画出)H:1 O:16 C:12
实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图(铁架台、铁夹、酒精灯等未画出)H:1 O:16 C:12