题目内容
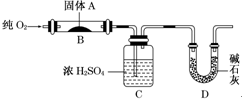 实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图(铁架台、铁夹、酒精灯等未画出)H:1 O:16 C:12
实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图(铁架台、铁夹、酒精灯等未画出)H:1 O:16 C:12取17.1g A放入装置中,通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题:
(1)通入过量O2的目的是
(2)C装置的作用是
(3)通过该实验,能否确定A中是否含有氧原子?
(4)若A的摩尔质量为342g/mol,C装置增重9.99g,D装置增重26.4g,则A的分子式为
(5)写出A燃烧的化学方程式;
(6)A可发生水解反应,1mol A可水解生成2mol同分异构体,则A在催化剂作用下水解的化学方程式为
考点:有机物实验式和分子式的确定
专题:
分析:(1)有机物在氧气中燃烧生成二氧化碳和水;
(2)浓硫酸吸收水,碱石灰吸收二氧化碳;
(3)根据质量守恒计算判断;
(4)根据浓硫酸和碱石灰增重的质量可计算有机物生成的水和二氧化碳的物质的量,根据C元素、H元素守恒和O元素守恒可计算有机物中C、H、O元素的物质的量,进而计算各元素的物质的量之比,最终可计算有机物的分子式;
(5)C12H22O11在氧气中燃烧生成二氧化碳和水;
(6)A可发生水解反应,1mol A可水解生成2mol同分异构体,则A为蔗糖,蔗糖水解生成葡萄糖和果糖.
(2)浓硫酸吸收水,碱石灰吸收二氧化碳;
(3)根据质量守恒计算判断;
(4)根据浓硫酸和碱石灰增重的质量可计算有机物生成的水和二氧化碳的物质的量,根据C元素、H元素守恒和O元素守恒可计算有机物中C、H、O元素的物质的量,进而计算各元素的物质的量之比,最终可计算有机物的分子式;
(5)C12H22O11在氧气中燃烧生成二氧化碳和水;
(6)A可发生水解反应,1mol A可水解生成2mol同分异构体,则A为蔗糖,蔗糖水解生成葡萄糖和果糖.
解答:
解:(1)燃烧法测定某固体有机物A的分子组成,要通入过量O2使有机物在氧气中充分燃烧生成二氧化碳和水;
故答案为:使有机物A充分燃烧;
(2)C装置中的试剂为浓硫酸,用于吸收有机物燃烧生成的水,D装置中的试剂是碱石灰用于吸收有机物燃烧生成的二氧化碳;
故答案为:吸收A燃烧后生成的H2O;吸收A燃烧后生成的CO2;
(3)通过浓硫酸增重的质量可以求出有机物中氢的质量,通过碱石灰增重的质量可以求出有机物中碳的质量,再根据A的质量判断是否有氧元素;
故答案为:能;
(4)浓硫酸增重可知水的质量为9.99g,可计算出n(H2O)=
=0.555mol,n(H)=1.11mol,m(H)=1.11g;使碱石灰增重26.4g,可知二氧化碳质量为26.4g,n(C)=n(CO2)=
=0.6mol,m(C)=7.2g,m(C)+m(H)=8.31g,有机物的质量为17.1g,所以有机物中氧的质量为8.79g,n(O)=
=0.55mol,
n(C):n(H):n(O)=0.6mol:1.11mol:0.55mol≈12:22:11,即实验式为C12H22O11,A的摩尔质量为342g/mol,所以分子式也为C12H22O11;
故答案为:C12H22O11;
(5)C12H22O11在氧气中燃烧生成二氧化碳和水,其反应的方程式为:C12H22O11+12O2
12CO2+11H2O;
答:A燃烧的化学方程式为:C12H22O11+12O2
12CO2+11H2O;
(6)A可发生水解反应,1mol A可水解生成2mol同分异构体,则A为蔗糖,蔗糖水解生成葡萄糖和果糖,其在催化剂作用下水解的化学方程式为C12H22O11(蔗糖)+H2O
C6H12O6(葡萄糖)+C6H12O6(果糖);
故答案为:C12H22O11(蔗糖)+H2O
C6H12O6(葡萄糖)+C6H12O6(果糖).
故答案为:使有机物A充分燃烧;
(2)C装置中的试剂为浓硫酸,用于吸收有机物燃烧生成的水,D装置中的试剂是碱石灰用于吸收有机物燃烧生成的二氧化碳;
故答案为:吸收A燃烧后生成的H2O;吸收A燃烧后生成的CO2;
(3)通过浓硫酸增重的质量可以求出有机物中氢的质量,通过碱石灰增重的质量可以求出有机物中碳的质量,再根据A的质量判断是否有氧元素;
故答案为:能;
(4)浓硫酸增重可知水的质量为9.99g,可计算出n(H2O)=
| 9.99g |
| 18g/mol |
| 26.4g |
| 44g/mol |
| 8.79g |
| 16g/mol |
n(C):n(H):n(O)=0.6mol:1.11mol:0.55mol≈12:22:11,即实验式为C12H22O11,A的摩尔质量为342g/mol,所以分子式也为C12H22O11;
故答案为:C12H22O11;
(5)C12H22O11在氧气中燃烧生成二氧化碳和水,其反应的方程式为:C12H22O11+12O2
| 点燃 |
答:A燃烧的化学方程式为:C12H22O11+12O2
| 点燃 |
(6)A可发生水解反应,1mol A可水解生成2mol同分异构体,则A为蔗糖,蔗糖水解生成葡萄糖和果糖,其在催化剂作用下水解的化学方程式为C12H22O11(蔗糖)+H2O
| 催化剂 |
故答案为:C12H22O11(蔗糖)+H2O
| 催化剂 |
点评:本题考查了有机物分子式的确定、有机方程式的书写等,题目难度中等,注意把握燃烧法测定有机物分子组成的方法.

练习册系列答案
相关题目
下列关于乙烯的说法中错误的是( )
| A、乙烯可以催熟植物的果实 |
| B、乙烯可以与水发生加成反应 |
| C、乙烯分子的空间构型是正四面体 |
| D、使用溴水或KMnO4 溶液,都可以鉴别乙烯和乙烷 |
从柑橘中提取得到结构简式如下图所示的化合物,则下列有关它的推断错误的是( )
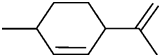

| A、分子式为C10H16 |
| B、常温下呈固态,比水重 |
| C、其一氯代物有8种 |
| D、能与溴水发生加成反应 |
下列溶液中微粒的物质的量浓度关系正确的是( )
| A、25℃时,pH=4.75、浓度均为0.1mol?L-1的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
| B、0.01mol?L-1 NaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+) |
| C、Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) |
| D、室温下,向0.01mol?L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
以铁为阳极、以铜为阴极,对足量的NaOH溶液进行电解.一段时间后得到2molFe(OH)3沉淀,此时共消耗的水的物质的量为( )
| A、2 mol |
| B、3 mol |
| C、4 mol |
| D、5 mol |
在密闭容器中发生如下反应:mA(g)+nB(g)?pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的
,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是( )
| 1 |
| 2 |
| A、m+n>p |
| B、平衡向逆反应方向移动 |
| C、A的转化率提高 |
| D、C的体积分数增加 |