题目内容
在T℃下,某反应达到平衡,平衡常数K=
.恒容时,温度升高,NO浓度减小.下列说法正确的是( )
| [NO][SO3] |
| [NO2][SO2] |
| A、该反应的焓变为正值 |
| B、恒温下减小压强,反应体系的颜色加深 |
| C、升高温度,逆反应速率减小 |
| D、该反应化学方程式为NO2+SO2?NO+SO3 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:平衡常数K=
.反应的化学方程式为NO2+SO2=NO+SO3恒容时,升高温度,NO浓度减小,说明平衡逆向进行,依据平衡移动原理和影响反应速率的因素分析选项;
A、NO2+SO2=NO+SO3,恒容时,升高温度,NO浓度减小,说明平衡逆向进行,逆反应为吸热反应,正反应为放热反应,焓变为负值;
B、反应前后气体体积不变,减小压强气体体积增大,混合气体颜色变浅;
C、升温正逆反应速率 都增大;
D、依据化学平衡常数概念书写化学方程式.
| [NO][SO3] |
| [NO2][SO2] |
A、NO2+SO2=NO+SO3,恒容时,升高温度,NO浓度减小,说明平衡逆向进行,逆反应为吸热反应,正反应为放热反应,焓变为负值;
B、反应前后气体体积不变,减小压强气体体积增大,混合气体颜色变浅;
C、升温正逆反应速率 都增大;
D、依据化学平衡常数概念书写化学方程式.
解答:
解:A、恒容时,升高温度,NO浓度减小,说明平衡逆向进行,逆反应为吸热反应,正反应为放热反应,焓变为负值,故A错误;
B、化学反应前后气体体积不变,减小压强气体体积增大,混合气体颜色变浅,故B错误;
C、升温反应速率增大,正逆反应速率都增大,故C错误;
D、依据化学平衡常数概念书写化学方程式为NO2+SO2=NO+SO3,故D正确;
故选D.
B、化学反应前后气体体积不变,减小压强气体体积增大,混合气体颜色变浅,故B错误;
C、升温反应速率增大,正逆反应速率都增大,故C错误;
D、依据化学平衡常数概念书写化学方程式为NO2+SO2=NO+SO3,故D正确;
故选D.
点评:本题考查了化学平衡常数概念分析,平衡常数和反应速率影响因素分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
以铁为阳极、以铜为阴极,对足量的NaOH溶液进行电解.一段时间后得到2molFe(OH)3沉淀,此时共消耗的水的物质的量为( )
| A、2 mol |
| B、3 mol |
| C、4 mol |
| D、5 mol |
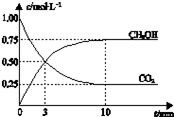 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.一定条件下,向体积为 1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.一定条件下,向体积为 1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )| A、升高温度能使CH3OH增加 |
| B、反应达到平衡状态时,CO2的平衡转化率为75% |
| C、3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 |
| D、从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol?L-1?min-1 |
在密闭容器中发生如下反应:mA(g)+nB(g)?pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的
,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是( )
| 1 |
| 2 |
| A、m+n>p |
| B、平衡向逆反应方向移动 |
| C、A的转化率提高 |
| D、C的体积分数增加 |
下列说法或表示法正确的是( )
| A、等量的白磷蒸气和白磷固体分别完全燃烧,后者放出热量多 |
| B、由C(石墨)→C(金刚石);△H=+1.19 kJ?mol-1可知,金刚石比石墨稳定 |
| C、在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ?mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ |
| D、在101KPa时,1molCH4完全燃烧生成CO2和水蒸气放出的热量就是CH4的燃烧热 |
焰火“脚印”“笑脸”“五环”,让北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关.下列说法中正确的是( )
| A、非金属单质燃烧时火焰均为无色 |
| B、焰色反应均应透过蓝色钴玻璃观察 |
| C、NaCl与Na2CO3灼烧时火焰颜色相同 |
| D、所有金属及其化合物灼烧时火焰均有颜色 |
 为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.