题目内容
18.反应 A+3B═2C+2D 在四种不同条件下的反应速率最快的是( )| A. | v(A)=0.3mol/(L•s) | B. | v(B)=0.6mol/(L•s) | C. | v(C)=0.4mol/(L•s) | D. | v(D)=0.45mol/(L•s) |
分析 比较四种不同情况下反应速率的快慢,利用速率除以其化学计量数之得到的速率进行比较即可.
解答 解:A、v=v(A)=0.3mol/(L•s);
B、v=$\frac{1}{3}$v(B)=0.1mol/(L•s);
C、v=$\frac{1}{2}$v(C)=0.2mol/(L•s);
D、v=$\frac{1}{2}$v(D)=0.225mol/(L•s);
反应速率最快的是A.
故选A.
点评 本题考查化学反应速率快慢比较,为高频考点,把握速率与其化学计量数比值大小比较或转化为同一物质表示的速率比较为解答的关键,题目难度不大.

练习册系列答案
相关题目
8.石墨烯可看作将石墨的层状结构一层一层地剥开得到的单层碳原子;石墨炔是平面网状结构的全碳分子,具有优良的化学稳定性和半导体性能,还可用于H2的提纯;将氢气氢化到石墨烯排列的六角晶格中,使每个碳原子都增加一个氢原子可得最薄的绝缘新材料石墨烷.下列有关说法中不正确的是( )
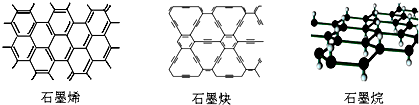

| A. | 石墨烯和石墨炔互为同素异形体 | |
| B. | 石墨炔有望替代二氧化硅用作半导体材料 | |
| C. | 12g石墨烯完全转变为石墨烷需标况下11.2L氢气 | |
| D. | 石墨炔孔径略大于H2分子的直径,因此它是理想的H2提纯薄膜 |
9.2008年奥运会在北京举行时用大型遥控飞艇作为宣传工具以渲染活动气氛,为了使飞艇在空中安全而有效,你认为飞艇内充入哪种气体最好( )
| A. | 氢气 | B. | 氦气 | C. | 氧气 | D. | 二氧化碳 |
6.在溶液中发生的反应,对反应速率不产生影响的因素是( )
| A. | 温度 | B. | 压强 | C. | 浓度 | D. | 催化剂 |
13.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 常温下,1 mol Fe与足量稀HNO3反应,转移电子的数目为2 NA | |
| B. | 18 g D2O中含有的质子数目为10 NA | |
| C. | 标准状况下,22.4 L二氯甲烷的分子数约为NA | |
| D. | 28 g由C2H4和C3H6组成的混合物中含有氢原子的数目为4 NA |
3.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
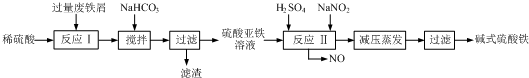
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH,使溶液中的Al3+沉淀,该工艺中“搅拌”的作用是加快反应速率.
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作氧化剂.若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH,使溶液中的Al3+沉淀,该工艺中“搅拌”的作用是加快反应速率.
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作氧化剂.若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.
 ,F元素离子基态时的电子排布式1s22s22p63s23p6,E元素的原子结构示意图是
,F元素离子基态时的电子排布式1s22s22p63s23p6,E元素的原子结构示意图是 .
.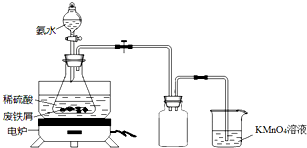 某实验小组用废铁屑(含少量S等元素)为原料制备三草酸合铁(Ⅲ)酸钾晶体[K3Fe(C2O4)3•3H2O]并测定其组成.
某实验小组用废铁屑(含少量S等元素)为原料制备三草酸合铁(Ⅲ)酸钾晶体[K3Fe(C2O4)3•3H2O]并测定其组成.