题目内容
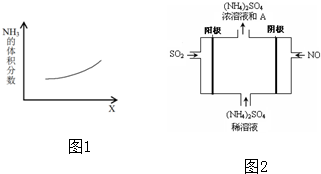
4.某化学小组的同学模拟工业制硝酸设计了如图所示的装置.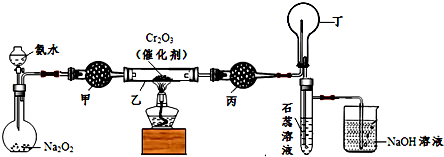
已知:CaCl2+nH2O→CaCl2•nH2O; CaCl2+8NH3→[Ca(NH3)8]Cl2
根据题意完成下列填空:
(1)分液漏斗中氨水的浓度为9.0mol/L.现用质量分数为0.35、密度为0.88g/cm3的氨水配制9.0mol/L的氨水100mL,需要的定量仪器有a、c(选填编号).
a.100mL容量瓶 b.10mL量筒 c.50mL量筒 d.电子天平
(2)受热时,乙中反应的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(3)实验开始先加热催化剂,当催化剂达红热时再打开分液漏斗活塞并移走酒精灯,可观察到的现象有:乙中Cr2O3仍能保持红热状态;丁的烧瓶中气体由无色转化为红棕色;试管里的石蕊试液由紫色变为红色;
(4)丙中盛放的药品为b(选填下列编号),其目的是吸收水及多余NH3.
a.浓H2SO4 b.无水CaCl2 c.碱石灰 d.无水CuSO4
(5)丁中除了NO之外,还可能存在的气体有N2、O2、NO2(N2O4)(填写化学式).烧杯中可能发生的反应的化学方程式2NO2+2NaOH=NaNO2+NaNO3+H2O、NO+NO2+2NaOH=2NaNO2+H2O.
分析 (1)依据C=$\frac{1000ρω}{M}$计算浓氨水的物质的量浓度,再根据浓氨水稀释前后溶质的物质的量不变计算;
(2)受热时,乙中为氨气和氧气在催化剂加热条件下发生反应生成一氧化氮和水;
(3)实验开始先加热催化剂,当催化剂达红热时再打开分液漏斗活塞并移走酒精灯,则生成的一氧化氮与装置的氧气反应生成红棕色的二氧化氮气体,二氧化氮溶于石蕊试液生成硝酸显酸性,所以石蕊试液由紫色变为红色,据此分析;
(4)丙为固体干燥管,为了除去过量的氨气和水蒸汽,所以盛放的药品为无水CaCl2;
(5)因为装置中含空气,一氧化氮与氧气生成二氧化氮,二氧化氮会转化成N2O4,所以丁中除了NO之外,还可能存在的气体有N2、O2、NO2 (N2O4);最终氢氧化钠是为了吸收多余的NO和NO2尾气,据此书写方程式.
解答 解:(1)浓氨水的浓度C=$\frac{1000ρω}{M}$=$\frac{1000×0.88g/c{m}^{3}×35%}{17g/mol}$=18.1mol/L,浓氨水稀释前后溶质的物质的量不变,设浓氨水的体积为V,所以18.1mol/L×V=9.0mol/L×0.1L,V=0.0497L=49.7mL;所以选用100mL容量瓶和50mL量筒,
故答案为:a、c;
(2)受热时,乙中为氨气和氧气在催化剂加热条件下发生反应生成一氧化氮和水,方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)实验开始先加热催化剂,当催化剂达红热时再打开分液漏斗活塞并移走酒精灯,则生成的一氧化氮与装置的氧气反应生成红棕色的二氧化氮气体,二氧化氮溶于石蕊试液生成硝酸显酸性,所以石蕊试液由紫色变为红色,所以可观察到的现象有丁的烧瓶中气体由无色转化为红棕色;试管里的石蕊试液由紫色变为红色;
故答案为:无;红棕色;由紫色变为红色;
(4)丙为固体干燥管,为了除去过量的氨气和水蒸汽,所以盛放的药品为无水CaCl2;
故答案为:b;吸收水及多余NH3;
(5)因为装置中含空气,一氧化氮与氧气生成二氧化氮,二氧化氮会转化成N2O4,所以丁中除了NO之外,还可能存在的气体有N2、O2、NO2 (N2O4);最终氢氧化钠是为了吸收多余的NO和NO2尾气,所以反应方程式为2NO2+2NaOH=NaNO2+NaNO3+H2O;NO+NO2+2NaOH=2NaNO2+H2O,
故答案为:N2、O2、NO2 (N2O4);2NO2+2NaOH=NaNO2+NaNO3+H2O;NO+NO2+2NaOH=2NaNO2+H2O.
点评 本题考查氨气的催化氧化,题目难度中等,涉及溶液的配制,气体制备、干燥(或除杂质)、性质验证、尾气处理,掌握常见气体的制备原理和除杂是解题关键,试题充分考查了学生的分析、理解能力及化学实验能力.

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案| A. | 平衡向逆反应方向移动 | B. | x+y<z | ||
| C. | C的体积分数降低 | D. | B的转化率降低 |
| A. | H3O+和OH- | B. | CO和N2 | C. | NH3和F- | D. | CH4和NO |
| A. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| B. | NaHCO3溶液中加入足量的Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 钠和水反应:Na+H2O═Na++OH-+H2↑ | |
| D. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- |
| X | Y | ||
| Z | W |
| A. | X 的最高价氧化物对应的水化物酸性最强 | |
| B. | 化合物XY2、ZY2均能溶于水生成含氧酸 | |
| C. | Y的氢化物比W的氢化物沸点高 | |
| D. | 四种元素中W原子半径最大 |
| A. | 既能与酸反应,又能与碱反应 | |
| B. | 导电性好 | |
| C. | 熔点低 | |
| D. | 具有还原性,在冶炼反应中放出大量的热量 |
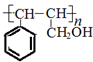 .
.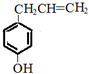 .
.
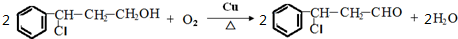 .
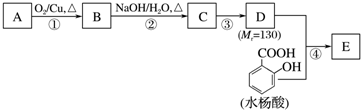
.
 .
.