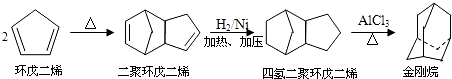
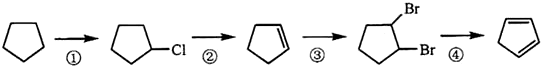
题目内容
9.X、Y、Z、W 四种短周期元素在周期表中的位置如图所示.这四种元素的原子最外层电子数之和为22,下列关于四种元素的说法正确的是( )| X | Y | ||
| Z | W |
| A. | X 的最高价氧化物对应的水化物酸性最强 | |
| B. | 化合物XY2、ZY2均能溶于水生成含氧酸 | |
| C. | Y的氢化物比W的氢化物沸点高 | |
| D. | 四种元素中W原子半径最大 |
分析 根据元素在周期表中的位置知,X、Y是第二周期元素而Z和W位于第三周期,设X原子最外层电子数是a,则Y、Z、W原子序数分别是a+1、a-1、a+2,这四种元素的原子最外层电子数之和为22,则a+a+1+a-1+a+2=22,则a=5,则X、Y、Z、W分别是N、O、Si、Cl元素;
A.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
B.二氧化硅不易溶于水;
C.氢化物的熔沸点与分子间作用力及氢键有关;
D.同一周期元素,原子半径随着原子序数增大而减小,同一主族元素,原子半径随着原子序数增大而减小.
解答 解:根据元素在周期表中的位置知,X、Y是第二周期元素而Z和W位于第三周期,设X原子最外层电子数是a,则Y、Z、W原子序数分别是a+1、a-1、a+2,这四种元素的原子最外层电子数之和为22,则a+a+1+a-1+a+2=22,则a=5,则X、Y、Z、W分别是N、O、Si、Cl元素;
A.N元素的最高价氧化物N2O5能够与水反应生成硝酸,但是HClO4的酸性比硝酸强,故A错误;
B.NO2能够溶于水,与水反应产生HNO3,而SiO2不能溶于水,也不能和水反应,故B错误;
C.水分子之间以氢键和分子间作用力结合,氢键比分子间作用力强很多,而HCl分子之间只有分子间作用力,所以Y的氢化物比W的氢化物沸点高,故C正确;
D.同一周期的元素,原子序数越大,原子半径越小;不同周期的元素,原子核外电子层数越多,原子半径越大,所以四种元素的原子中Si原子半径最大,故D错误;
故选C.
点评 本题考查元素周期律,为高频考点,侧重考查学生分析判断能力,明确原子结构、物质结构和性质是解本题关键,易错选项是C,注意:氢化物的熔沸点与分子间作用力和氢键有关,氢化物的稳定性与化学键有关,题目难度不大.

| A. | X、Y、Z、W的原子半径依次减小 | |
| B. | W与X形成的化合物中只含离子键 | |
| C. | W含氧酸的酸性一定比Z的含氧酸的酸性强 | |
| D. | 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
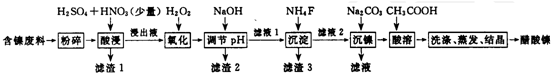
相关离子生成氢氧化物的pH和相关物质的溶解性如表:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时溶解性(H2O) | |
| Fe3+ | 1.1 | 3.2 | CaS04 | 微溶 | |
| Fe2+ | 5.8 | 8.8 | NiF | 可溶 | |
| Al3+ | 3.0 | 5.0 | CaF2 | 难溶 | |
| Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.6×10-4 |
(2)滤液1和滤液3主取成分的化学式分別是SiO2、CaSO4、CaF2.
(3)写出氧化步骤中加入H2O2发生反应的离子方程式2Fe2++H2O2+2H+═2Fe3++2H2O.
(4)酸浸过程中,1mol NiS失去6NA个电子,同时生成两种无色有毒气体.写出该反应的化学方程式NiS+H2SO4+2HNO3═NiSO4+SO2↑+2NO↑+2H2O.
(5)沉镍过程中,若c(Ni2+)=2.0mol•L-1,欲使100ml该滤液中的Ni2+沉淀物完全,[c(Ni2+)≤10-5mol•L-1],则需要加人Na2CO3固体的质量最少为1038.8g(保留小数点后1位有效数字)
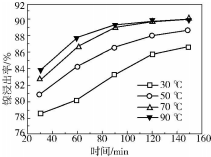
(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸.酸浸出率随时间变化如图.酸浸的最佳温度与时间分别为70℃、120min.
| A. | F2 | B. | Cl- | C. | NH3 | D. | NH2- |
| A. | 0.1 mol•L-1 AgNO3溶液:H+、K+、SO42-、I- | |
| B. | 使甲基橙变红的溶液中:Fe2+、Al3+、NO3-、Cl-、S2- | |
| C. | $\frac{Kw}{c(H+)}$=0.1 mol•L-1的溶液:Na+、K+、SiO32-、AlO2- | |
| D. | 与铝反应产生大量H2的溶液中:Na+、NH4+、C6H5O-、CH3COO- |
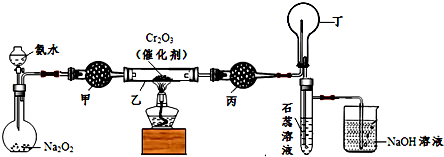
 在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.
在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.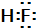 ;从HF、HCl混合气体中分离出HF的方法是冷凝.
;从HF、HCl混合气体中分离出HF的方法是冷凝.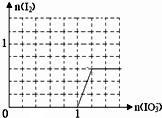 .
.