题目内容
6.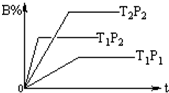 已知某可逆反应:mA(g)+nB(g)═fC(g),在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是( )
已知某可逆反应:mA(g)+nB(g)═fC(g),在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是( )| A. | T2>T1 P1>P2 m+n>f△H<0 | B. | T1>T2 P1<P2 m+n<f△H>0 | ||
| C. | T1<T2 P1<P2 m+n<f△H<0 | D. | T1>T2 P1<P2 m+n>f△H>0 |
分析 温度相同时,根据到达平衡的时间判断压强大小,再根据压强对B的含量的影响,判断压强对平衡的影响,确定反应气体气体体积变化情况;压强相同时,根据到达平衡的时间判断温度大小,再根据温度对B的含量的影响,判断温度对平衡的影响,确定反应的热效应.
解答 解:由图象可知,温度为T1时,根据到达平衡的时间可知P2>P1,且压强越大,B的含量高,说明压强增大平衡向逆反应方向移动,故正反应为气体体积增大的反应,即m+n<f;压强为P2时,根据到达平衡的时间可知T1>T2,且温度越高,B的含量低,说明温度升高平衡向正反应方向移动,则正反应为吸热反应,即△H>0,
故选B.
点评 本题考查化学平衡图象问题,难度不大,本题注意根据图象判断温度、压强的大小,根据温度、压强对平衡移动的影响分析.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.表中,第Ⅰ栏和第Ⅱ栏的化学反应都可以用第Ⅲ栏的离子方程式表示的是( )
| 编号 | 第Ⅰ栏 | 第Ⅱ栏 | 第Ⅲ栏 |
| A | H2SO4溶液中滴加Ba(OH)2至恰好沉淀完全 | 在NaHSO4溶液中滴加Ba(OH)2至中性 | H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| B | 氢氧化钠溶液中通入过量CO2 | 氢氧化钙溶液中滴入过量CO2 | OH-+CO2═HCO3- |
| C | 向碳酸氢铵溶液中加过量澄清石灰水 | 向碳酸氢钠溶液中加过量澄清石灰水 | HCO3-+Ca2++OH-═CaCO3↓+H2O |
| D | FeBr2溶液和少量Cl2反应 | FeI2溶液和少量Cl2反应 | 2Fe2++Cl2═2Fe3++2Cl- |
| A. | A | B. | B | C. | C | D. | D |
17.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向NaAlO2溶液通入过量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | 磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+2I-+8H+═3Fe2++I2+4H2O | |
| C. | 用FeS除去工业废水中的Hg2+:Hg2++S2-═HgS↓ | |
| D. | 向饱和的Ca(OH)2溶液中滴加过量NaHCO3溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O |
14.有机物CH2=CHCH2CH(OH)COOH在不同条件下至少可能发生7种不同类型的反应:①取代 ②加成 ③消去 ④氧化 ⑤酯化 ⑥缩聚 ⑦加聚,其中可能由于分子结构中含有“-OH”而发生的反应( )
| A. | ①③⑤⑦ | B. | ②④⑥⑦ | C. | ②③④⑤ | D. | ①③④⑤⑥ |
1.如图是关于反应aA2(g)+bB2(g)?cC(g)△H<0 的平衡移动图象,影响平衡移动的原因可能是( )

| A. | 升高温度,同时加压 | |
| B. | 降低温度,同时减压 | |
| C. | 增大反应物浓度,同时减小生成物浓度 | |
| D. | 增大反应物浓度,同时升高温度 |
11.化学中常借助曲线图来表示某种变化过程,如:①平衡移动过程 ②中和滴定过程 ③沉淀的生成和溶解过程 ④固体物质的溶解度变化过程.下列曲线图中从左到右依次表示上述过程的正确顺序是( )
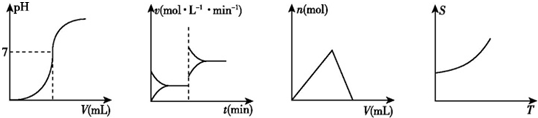

| A. | ①②③④ | B. | ②①③④ | C. | ③②②① | D. | ②③①④ |
18.四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题.
(1)Z在元素周期表中位于ⅣA族.
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是Na(填元素符号).
(3)①下列可作为比较X和Y金属性强弱的依据是bc(填序号).
a.自然界中的含量
b.相应氯化物水溶液的pH
c.单质与水反应的难易程度
d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因:电子层相同,核电荷数Al>Na,原子半径Na>Al,所以原子核对最外层电子的吸引力Na<Al,失电子能力Na>Al.
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似.体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是HN3+NaOH═NaN3+H2O,混合后溶液中离子浓度由大到小的顺序是c(Na+)>c(N3-)>c(OH-)>c(H+).
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.
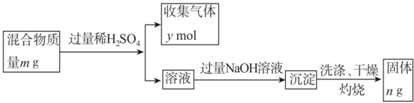
能确定混合物中Y的质量分数的数据有abc(填序号).
a.m、n b.m、y c.n、y.
| W | X | Y | Z | |
| 结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是Na(填元素符号).
(3)①下列可作为比较X和Y金属性强弱的依据是bc(填序号).
a.自然界中的含量
b.相应氯化物水溶液的pH
c.单质与水反应的难易程度
d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因:电子层相同,核电荷数Al>Na,原子半径Na>Al,所以原子核对最外层电子的吸引力Na<Al,失电子能力Na>Al.
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似.体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是HN3+NaOH═NaN3+H2O,混合后溶液中离子浓度由大到小的顺序是c(Na+)>c(N3-)>c(OH-)>c(H+).
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.

能确定混合物中Y的质量分数的数据有abc(填序号).
a.m、n b.m、y c.n、y.
15.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.1molNa与O2在一定条件下生成Na2O和Na2O2混合物时,失去电子数为0.2NA | |
| B. | 50mL 12mol•L-1浓盐酸与足量二氧化锰加热反应,生成Cl2的分子数为0.15NA | |
| C. | 常温下,100mL 1mol•L-1Na2CO3溶液中阴离子总数等于0.1NA | |
| D. | 标准状况下,6.72LCO2中所含的共用电子对数为1.2NA |
12.下列实际应用与水解知识无关的是( )
| A. | 处理锅炉水垢的CaSO4,可先用Na2CO3溶液处理,再用酸去除 | |
| B. | 向TiCl4中加入大量的水,同时加热,可以制备纳米材料制备TiO2 | |
| C. | AlCl3溶液蒸干灼烧得不到AlCl3,而用SOCl2与AlCl3•6H2O混合共热可得无水AlCl3 | |
| D. | 铵态氮肥不可与草木灰同时使用 |