题目内容
11.化学中常借助曲线图来表示某种变化过程,如:①平衡移动过程 ②中和滴定过程 ③沉淀的生成和溶解过程 ④固体物质的溶解度变化过程.下列曲线图中从左到右依次表示上述过程的正确顺序是( )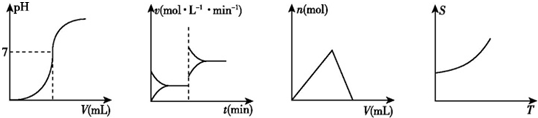
| A. | ①②③④ | B. | ②①③④ | C. | ③②②① | D. | ②③①④ |
分析 ①平衡移动的本质为正反应、逆反应速率改变程度不相等;
②中和滴定过程,是酸和碱反应生成盐和水的过程,酸滴定碱,开始溶液PH>7,开始碱滴定酸,PH<7;
③沉淀的生成和溶解,图象应先沉淀增加,后沉淀溶解,图象与横坐标有2个交点,图象中有拐点;
④固体物质的溶解度变化过程,物质的溶解度随温度升高或降低.
解答 解:由图可知,图中曲线从左到右依次表示为:
②中和滴定过程:如向一定量的盐酸中滴加一定浓度的氢氧化钠溶液时pH逐渐增大;
①平衡移动过程:反应达到平衡的标志是正逆反应速率相等,各组分的含量保持不变,图象中表示,当改变某一条件,正反应、逆反应速率改变程度不相等,平衡移动;
③沉淀的生成和溶解:图象应先沉淀增加,后沉淀溶解,如图象中可表示:向一定量的氯化铝溶液中滴加一定浓度的氢氧化钠溶液,首先发生反应Al3++3OH-=Al(OH)3↓,Al3+反应完毕,继续滴加NaOH溶液,发生反应OH-+Al(OH)3=AlO2-+H2O,故先生成沉淀,后沉淀溶解;
④固体物质的溶解度变化过程:大部分固体物质的溶解度温度的升高而增大,如KNO3;只有少数固体物质的溶解度受温度的影响不大,如NaCl;极少数固体物质的溶解度随温度升高而减小,如Ca(OH)2.图中可表示大部分固体物质的溶解度温度的升高而增大的过程;
综上可知:图中从左到右依次表示②①③④,
故选B.
点评 本题考查较为综合,以图象形式考查平衡移动、中和滴定、沉淀的生成和溶解、溶解度等知识,注意有关反应的原理,熟悉物质的性质注意把握NaCl、Ca(OH)2的溶解性的特殊性,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.硫酸铜、硝酸铁都是重要的化工原料.
(1)以下是某工厂用含铁的废铜为原料生产胆矾(CuSO4•5H2O)的生产流程示意图(如图1):
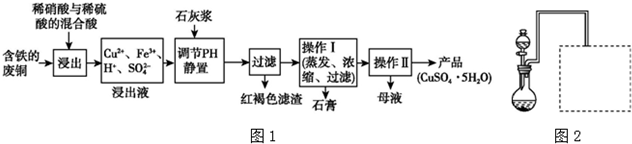
胆矾和石膏在不同温度下的溶解度(g/100 g水)见表.
请回答下列问题:①红褐色滤渣的主要成分是Fe(OH)3;
②写出浸出过程中生成硫酸铜的化学方程式3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O;
③操作I的温度应该控制在100℃左右;
④从溶液中分离出硫酸铜晶体的操作Ⅱ应为:将热溶液冷却结晶、过滤、洗涤、干燥.
(2)某兴趣小组在实验室用铁粉和稀硝酸及如图装置制取Fe(NO3)3(固定所用仪器和加热装置未画出).
①为保证原料的充分利用,并加快反应速率,往往将加热温度控制在100℃以内.该实验中对圆底烧瓶加热的最佳方式是水浴加热;
②请在图2中虚线框内画出尾气吸收装置
(提示:碱液可快速、充分吸收产生的氮氧化物气体).
(1)以下是某工厂用含铁的废铜为原料生产胆矾(CuSO4•5H2O)的生产流程示意图(如图1):

胆矾和石膏在不同温度下的溶解度(g/100 g水)见表.
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
②写出浸出过程中生成硫酸铜的化学方程式3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O;
③操作I的温度应该控制在100℃左右;
④从溶液中分离出硫酸铜晶体的操作Ⅱ应为:将热溶液冷却结晶、过滤、洗涤、干燥.
(2)某兴趣小组在实验室用铁粉和稀硝酸及如图装置制取Fe(NO3)3(固定所用仪器和加热装置未画出).
①为保证原料的充分利用,并加快反应速率,往往将加热温度控制在100℃以内.该实验中对圆底烧瓶加热的最佳方式是水浴加热;
②请在图2中虚线框内画出尾气吸收装置
(提示:碱液可快速、充分吸收产生的氮氧化物气体).
19.有A、B、C、D四块金属片,进行如下实验:
①A、B用导线连接后,同时浸入稀H2SO4溶液中,A极为负极;
②C、D用导线连接后,同时浸入稀H2SO4溶液中,电流由D→导线→C;
③A、C相连后,同时浸入稀H2SO4溶液中,C极上产生大量气泡,但质量无明显变化;
④B、D用导线连接后,同时浸入稀H2SO4溶液中,D极上发生氧化反应.
据此,判断四种金属的活动性顺序是( )
①A、B用导线连接后,同时浸入稀H2SO4溶液中,A极为负极;
②C、D用导线连接后,同时浸入稀H2SO4溶液中,电流由D→导线→C;
③A、C相连后,同时浸入稀H2SO4溶液中,C极上产生大量气泡,但质量无明显变化;
④B、D用导线连接后,同时浸入稀H2SO4溶液中,D极上发生氧化反应.
据此,判断四种金属的活动性顺序是( )
| A. | A>B>C>D | B. | A>C>D>B | C. | C>A>B>D | D. | B>D>C>A |
6.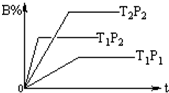 已知某可逆反应:mA(g)+nB(g)═fC(g),在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是( )
已知某可逆反应:mA(g)+nB(g)═fC(g),在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是( )
 已知某可逆反应:mA(g)+nB(g)═fC(g),在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是( )
已知某可逆反应:mA(g)+nB(g)═fC(g),在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是( )| A. | T2>T1 P1>P2 m+n>f△H<0 | B. | T1>T2 P1<P2 m+n<f△H>0 | ||
| C. | T1<T2 P1<P2 m+n<f△H<0 | D. | T1>T2 P1<P2 m+n>f△H>0 |
3.设NA为阿伏加德罗常数的值,下列关于0.2 mol•L-1Ba(NO3)2溶液的说法不正确的是( )
| A. | 1 L溶液中含Ba2+、N${O}_{3}^{-}$的总数是0.6NA | |
| B. | 500 mL溶液中Ba2+的浓度是0.2 mol•L-1 | |
| C. | 500 mL溶液中N${O}_{3}^{-}$的浓度是0.2 mol•L-1 | |
| D. | 1 L溶液中含有0.4NA个N${O}_{3}^{-}$ |
20.下列实验操作能达到相应实验目的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 将二氧化硫气体通入紫色石蕊试液中,观察溶液颜色变化 | 证明二氧化碳具有漂白性 |
| B | 向2mL1mol•L-1NaOH溶液中先加入3滴1mol•L-1FeCl3溶液,再加入3滴1mol•L-1MgCl2溶液 | 证明Ksp[Mg(OH)2]>ksp[Fe(OH)3] |
| C | 向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴含NaClO的“84”消毒液,观察红色褪色的快慢 | 证明随着溶液pH的减小,“84”消毒液的氧化能力增强 |
| D | 相同温度下,向两支盛有相同体积不同浓度H2O2溶液的试管中分别滴入适量相同浓度的CuSO4溶液和FeCl3溶液 | 探究Cu2+、Fe3+对H2O2分解速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
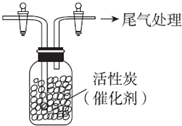 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
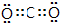 .
.