题目内容
17.下列表示对应化学反应的离子方程式正确的是( )| A. | 向NaAlO2溶液通入过量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | 磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+2I-+8H+═3Fe2++I2+4H2O | |
| C. | 用FeS除去工业废水中的Hg2+:Hg2++S2-═HgS↓ | |
| D. | 向饱和的Ca(OH)2溶液中滴加过量NaHCO3溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O |
分析 A.二氧化碳过量反应生成氢氧化铝和碳酸氢钠;
B.三价铁离子具有强的氧化性能够氧化碘离子;
C.硫化亚铁为沉淀,应保留化学式;
D.碳酸氢钠过量反应生成碳酸钙、碳酸钠和水.
解答 解:A.向NaAlO2溶液中通入过量CO2,反应生成氢氧化铝和碳酸氢钠,离子反应为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故A错误;
B.磁性氧化铁(Fe3O4)溶于氢碘酸,离子方程式:Fe3O4+2I-+8H+═3Fe2++I2+4H2O,故B正确;
C.用FeS除去工业废水中的Hg2+,离子方程式:Hg2++FeS═HgS+Fe2+,故C错误;
D.向饱和的Ca(OH)2溶液中滴加过量NaHCO3溶液,离子方程式:2HCO3-+Ca2++OH-═CaCO3↓+2H2O+CO32-,
故D错误;
故选:B.
点评 本题考查了离子方程式的书写,把握发生的反应及离子反应的书写方法为解答的关键,注意反应物用量对反应的影响,题目难度不大.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
8.配制250 mL 0.10 mol•L-1的NaOH溶液时,下列实验操作会使配制的溶液浓度偏高的是( )
| A. | 容量瓶内有水,未经过干燥处理 | |
| B. | 定容时,仰视刻度线 | |
| C. | 用量筒量取浓NaOH溶液时,用水洗涤量筒2~3次,洗涤液倒入烧杯中 | |
| D. | 定容后倒转容量瓶几次,发现液体最低点低于刻度线,再补加几滴水到刻度线 |
12.引燃密闭恒容容器中的己烷和氧气的混合气体,使其进行不完全燃烧,在120℃时测得反应前后气体的压强分别为0.36×105 Pa和0.52×105 Pa,这一燃烧反应中主要发生的化学反应方程式是( )
| A. | C6H14+9O2→CO+5CO2+7H2O | B. | C6H14+7O2→5CO+CO2+7H2O | ||
| C. | C6H14+8O2→3CO+3CO2+7H2O | D. | 2C6H14+15O2→8CO+4CO2+14H2O |
6. 已知某可逆反应:mA(g)+nB(g)═fC(g),在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是( )
已知某可逆反应:mA(g)+nB(g)═fC(g),在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是( )
 已知某可逆反应:mA(g)+nB(g)═fC(g),在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是( )
已知某可逆反应:mA(g)+nB(g)═fC(g),在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是( )| A. | T2>T1 P1>P2 m+n>f△H<0 | B. | T1>T2 P1<P2 m+n<f△H>0 | ||
| C. | T1<T2 P1<P2 m+n<f△H<0 | D. | T1>T2 P1<P2 m+n>f△H>0 |
3.在1L溶液中溶有16.0g CuSO4和20g Fe2(SO4)3,向该溶液中加入9.75g Zn,充分反应后,溶液中含有的离子是( )
| A. | Zn2+、Fe2+和Cu2+ | B. | Zn2+、Fe3+和Cu2+ | C. | Fe2+和Zn2+ | D. | Cu2+ 和Zn2+ |
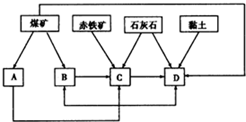 我国某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O3,还含有SiO2等杂质)、煤矿、石灰石和黏土.拟在该地区建设大型炼铁厂.
我国某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O3,还含有SiO2等杂质)、煤矿、石灰石和黏土.拟在该地区建设大型炼铁厂. A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:
A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系: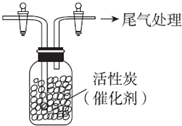 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.