题目内容
18.四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题.| W | X | Y | Z | |
| 结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是Na(填元素符号).
(3)①下列可作为比较X和Y金属性强弱的依据是bc(填序号).
a.自然界中的含量
b.相应氯化物水溶液的pH
c.单质与水反应的难易程度
d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因:电子层相同,核电荷数Al>Na,原子半径Na>Al,所以原子核对最外层电子的吸引力Na<Al,失电子能力Na>Al.
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似.体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是HN3+NaOH═NaN3+H2O,混合后溶液中离子浓度由大到小的顺序是c(Na+)>c(N3-)>c(OH-)>c(H+).
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.
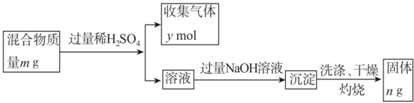
能确定混合物中Y的质量分数的数据有abc(填序号).
a.m、n b.m、y c.n、y.
分析 四种短周期元素W、X、Y、Z,原子序数依次增大,W最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物,则W为N元素;X焰色反应呈黄色,则X为Na;Y、Z原子序数大于Na,二者处于第三周期,在同周期主族元素形成的简单离子中,Y的离子半径最小,则Y为Al,Z最高正价与最低负价之和为零,则Z为Si元素,据此解答.
解答 解:四种短周期元素W、X、Y、Z,原子序数依次增大,W最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物,则W为N元素;X焰色反应呈黄色,则X为Na;Y、Z原子序数大于Na,二者处于第三周期,在同周期主族元素形成的简单离子中,Y的离子半径最小,则Y为Al,Z最高正价与最低负价之和为零,则Z为Si元素.
(1)Z是Si元素,处于第ⅣA族,故答案为:ⅣA;
(2)W形成的最高价氧化物的水化物是硝酸,X的最高价氧化物的水化物是氢氧化钠,Y的最高价氧化物的水化物是氢氧化铝,Z的最高价氧化物的水化物是硅酸,氢氧化钠和其他三种物质能反应,所以该元素是Na,故答案为:Na;
(3)①比较金属性强弱的方法有:金属元素最高价氧化物的水化物碱性强弱、金属之间的置换反应、和酸或水反应生成氢气的难易程度、形成的氯化物溶液酸性强弱等,故选:bc;
②电子层相同,核电荷数Al>Na,原子半径Na>Al,所以原子核对最外层电子的吸引力Na<Al,失电子能力Na>Al,
故答案为:电子层相同,核电荷数Al>Na,原子半径Na>Al,所以原子核对最外层电子的吸引力Na<Al,失电子能力Na>Al;
(4)HN3的酸性与醋酸的相当,则HN3为弱酸,与NaOH发生中和反应,反应方程式为:HN3+NaOH═NaN3+H2O;等体积、等浓度,二者恰好反应,为NaN3溶液,NaN3溶液中N3-水解,溶液呈碱性,故溶液中离子浓度顺序为c(Na+)>c(N3-)>c(OH-)>c(H+),
故答案为:HN3+NaOH═NaN3+H2O;c(Na+)>c(N3-)>c(OH-)>c(H+);
(5)镁、铝和稀硫酸反应生成硫酸镁、硫酸铝和氢气,硫酸镁、硫酸铝和氢氧化钠溶液反应生成氢氧化镁、氢氧化铝,氢氧化铝和氢氧化钠反应生成偏铝酸钠,氢氧化镁和氢氧化钠溶液不反应,灼烧氢氧化镁固体,氢氧化镁分解生成氧化镁和水,所以最后所得固体是氧化镁.
a.根据n的量计算镁的质量,根据m、n计算铝质量,从而计算铝的质量分数,故正确;
b.根据镁、铝的质量及镁铝和稀硫酸反应生成氢气的量计算铝和镁质量,从而计算铝的质量分数,故正确;
c.根据n的质量计算镁的质量,根据镁的量计算镁和稀硫酸反应生成氢气的量,从而得出铝和稀硫酸反应生成氢气的量,故而得出铝的质量分数,故正确,
故选:abc.
点评 本题考查元素周期表及有关推断、实验的设计、分析及评价等,推断元素是解题关键,注意掌握金属性、非金属性强弱比较实验事实,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 容量瓶内有水,未经过干燥处理 | |
| B. | 定容时,仰视刻度线 | |
| C. | 用量筒量取浓NaOH溶液时,用水洗涤量筒2~3次,洗涤液倒入烧杯中 | |
| D. | 定容后倒转容量瓶几次,发现液体最低点低于刻度线,再补加几滴水到刻度线 |
 已知某可逆反应:mA(g)+nB(g)═fC(g),在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是( )
已知某可逆反应:mA(g)+nB(g)═fC(g),在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是( )| A. | T2>T1 P1>P2 m+n>f△H<0 | B. | T1>T2 P1<P2 m+n<f△H>0 | ||
| C. | T1<T2 P1<P2 m+n<f△H<0 | D. | T1>T2 P1<P2 m+n>f△H>0 |
| A. | 能溶解Al2O3的溶液:Na+、K+、HCO${\;}_{3}^{-}$、NO${\;}_{3}^{-}$ | |
| B. | 0.1mol•L-1Ca(ClO)2溶液:K+、Na+、I-、Cl- | |
| C. | 能使石蕊显红色的溶液:K+、Fe2+、Cl-、NO${\;}_{3}^{-}$ | |
| D. | 加入KSCN显红色的溶液:Na+、Mg2+、Cl-、SO${\;}_{4}^{2-}$ |
| A. | 1 L溶液中含Ba2+、N${O}_{3}^{-}$的总数是0.6NA | |
| B. | 500 mL溶液中Ba2+的浓度是0.2 mol•L-1 | |
| C. | 500 mL溶液中N${O}_{3}^{-}$的浓度是0.2 mol•L-1 | |
| D. | 1 L溶液中含有0.4NA个N${O}_{3}^{-}$ |
| A. | 砹(第ⅦA)是一种有色固体,它的气态氰化物很不稳定,砹化银为有色沉淀,且不溶解于稀硝酸,但是容易分解 | |
| B. | 在周期表中金属和非金属元素的分界线附件可以寻找制取新农药的元素 | |
| C. | 铷的硫酸盐易溶解于水,其氢氧化物一定是强碱 | |
| D. | 溴化氢没有氯化氢稳定,其水溶液的酸性比较为:盐酸>氢溴酸 |
| A. | Zn2+、Fe2+和Cu2+ | B. | Zn2+、Fe3+和Cu2+ | C. | Fe2+和Zn2+ | D. | Cu2+ 和Zn2+ |
| A. | 将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO | |
| B. | 在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7 Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O | |
| D. | 向NaHCO3 溶液中滴入过量的Ba(OH)2溶液:HCO3-+Ba2++OH-═H2O+BaCO3↓ |
