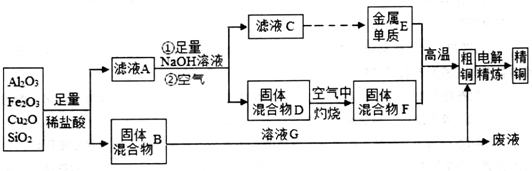
题目内容
10.仅根据题中图示得出的结论不合理的是( )| A | B | C | D | |
图示 | 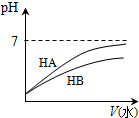 | 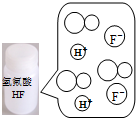 | 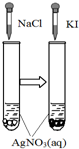 | 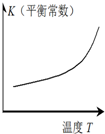 |
| 结论 | HB为弱酸 | HF为弱电解质 | 溶解度:AgI<AgCl | 正反应△H>0 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.加水稀释相同的倍数弱酸的pH变化小;
B.溶液中存在分子,说明HF没有完全电离;
C.一定条件下,AgCl可以转化为AgI;
D.升高温度K增大,说明向正反应方向移动.
解答 解:A.加水稀释相同的倍数弱酸的pH变化小,HB溶液的pH变化小,所以HB为弱酸,故A正确;
B.溶液中存在分子,说明HF没有完全电离,即HF为弱酸,故B正确;
C.一定条件下,AgCl可以转化为AgI,但是不能说明AgI的溶解度小于AgCl的溶解度,故C错误;
D.升高温度K增大,说明向正反应方向移动,即正反应方向为吸热方向,所以正反应△H>0,故D正确.
故选C.
点评 本题考查了弱电解质的电离、沉淀的转化、温度对化学平衡和平衡常数的影响,题目涉及的知识点较多,侧重于考查学生对基础知识的应用能力,题目难度中等.

练习册系列答案
相关题目
13.下列有关苯的叙述中不正确的是( )
| A. | 苯在催化剂作用下能与浓硝酸发生取代反应 | |
| B. | 在一定条件下苯能与氢气发生加成反应 | |
| C. | 在苯中加入酸性高锰酸钾溶液,振荡并静置后下层液体为紫红色 | |
| D. | 在苯中加入溴水,振荡后会发生反应 |
1.1元硬币的外观有银白色的金属光泽,一些同学认为它可能是铁制的.在讨论时,有的同学提出“我们可以先拿磁铁来吸一下”,于是就拿磁铁来吸了一下.这一过程属于科学探究的( )
| A. | 假设 | B. | 实验 | C. | 做结论 | D. | 观察 |
5.下列叙述中正确的是( )
| A. | 在食用盐中滴加少量淀粉溶液,探究食用盐是否含有IO3- | |
| B. | 新制氯水显酸性,将其滴加到紫色石蕊溶液中,充分振荡后溶液最终为无色 | |
| C. | 氯气具有漂白性,可以将湿润的有色布条漂白为无色物质 | |
| D. | 根据较强酸可以制取较弱酸的规律,结合酸性的强弱顺序H2CO3>HClO>HCO3-,可以推出少量的CO2通入NaClO溶液中能生成HClO和碳酸钠 |
15. (1)已知在常温下,常见弱酸和弱碱的电离平衡常数如下表所示:
(1)已知在常温下,常见弱酸和弱碱的电离平衡常数如下表所示:
浓度均为0.1mol•L-1的下列5种溶液:
①CH3COONH4 ②CH3COONa ③NaNO2 ④HF ⑤NH4Cl,
溶液pH值由小到大的顺序是(填写编号)④⑤①③②.
(2)如图表示某溶液中c(H+)和c(OH-)的关系,下列判断正确的是AC.
A.两条曲线间任意点均有c(H+)×c(OH-)=Kw
B.AB线上任意点均有pH=7
C.图中T1<T2
D.M区域内(阴暗部分)任意点均有c(H+)>c(OH-)
 (1)已知在常温下,常见弱酸和弱碱的电离平衡常数如下表所示:
(1)已知在常温下,常见弱酸和弱碱的电离平衡常数如下表所示:| 电解质 | HF | CH3COOH | HNO2 | NH3•H2O |
| 电离平衡常数K | 3.53×10-4 | 1.76×10-5 | 4.6×10-4 | 1.77×10-5 |
①CH3COONH4 ②CH3COONa ③NaNO2 ④HF ⑤NH4Cl,
溶液pH值由小到大的顺序是(填写编号)④⑤①③②.
(2)如图表示某溶液中c(H+)和c(OH-)的关系,下列判断正确的是AC.
A.两条曲线间任意点均有c(H+)×c(OH-)=Kw
B.AB线上任意点均有pH=7
C.图中T1<T2
D.M区域内(阴暗部分)任意点均有c(H+)>c(OH-)
2.下列关于离子浓度的说法正确的是( )
| A. | 一定浓度的氨水加水稀释的过程中,c(NH4+)/c(NH3•H2O)的比值减小 | |
| B. | pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)>c(CH3COO -) | |
| C. | 常温下0.4mol/LHB溶液和0.2mol/LNaOH溶液等体积混合后溶液的pH=3,则溶液中微粒浓度存在下面关系:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-) | |
| D. | c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c(NH4)2SO4>c(NH4Cl) |



 +2H2O.
+2H2O.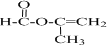 .
.