题目内容
5.下列叙述中正确的是( )| A. | 在食用盐中滴加少量淀粉溶液,探究食用盐是否含有IO3- | |
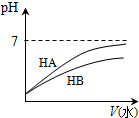
| B. | 新制氯水显酸性,将其滴加到紫色石蕊溶液中,充分振荡后溶液最终为无色 | |
| C. | 氯气具有漂白性,可以将湿润的有色布条漂白为无色物质 | |
| D. | 根据较强酸可以制取较弱酸的规律,结合酸性的强弱顺序H2CO3>HClO>HCO3-,可以推出少量的CO2通入NaClO溶液中能生成HClO和碳酸钠 |
分析 A、碘酸钾与淀粉不反应;
B、新制氯水含有HClO,具有漂白性;
C、氯气无漂白性,氯气和水反应生成的次氯酸具有漂白性;
D、反应进行符合复分解反应的规律.
解答 解:A、食盐中含有碘酸钾,碘酸钾与淀粉不反应,故A错误;
B、新制氯水含有HClO,具有漂白性,向其中滴加少量紫色石蕊试液,溶液先变红后褪色,故B正确;
C、氯气无漂白性,氯气可以使湿润的有色布条褪色,是因为氯气和水反应生成的次氯酸具有漂白性,故C错误;
D、由于碳酸钠会与次氯酸反应,所以应该生成碳酸氢钠,故D错误.
故选B.
点评 本题综合考查元素化合物知识,为高考常见题型,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
9.已知:①lmolH2分子中化学键断裂时需要吸收436kJ的能量②1mol C12分子中化学键断裂时需要吸收243kJ的能量③由H原子和C1原子形成l mol HCl分子时释放431kJ的能量下列叙述中正确的是( )
| A. | 氢气和氯气反应生成氯化氢气体的热化学方程式是:H2(g)+Cl2(g)=2HCl(g) | |
| B. | 氢气和氯气反应生成2mol氯化氢气体,反应的△H=+183KJ•mol-1 | |
| C. | 氢气和氯气反应生成2mol氯化氢气体,反应的△H=-183KJ•mol-1 | |
| D. | 氢气和氯气反应生成1mol氯化氢气体,反应的△H=+183KJ•mol-1 |
17.在100mL某混合溶液中,c(HNO3)=0.4mol/L,c(H2SO4)=0.25mol/L,向其中加入 1.92g铜粉,微热,充分反应后溶液中c(NO3-)约为( )
| A. | 0.15mol/L | B. | 0.20mol/L | C. | 0.225mol/L | D. | 0.30mol/L |
15.Al、Fe、Cu都是重要的金属元素.下列说法正确的是( )
| A. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 | |
| B. | 三者的单质放置在空气中均只生成氧化物 | |
| C. | 工业上,三者的单质目前都使用热还原法制得 | |
| D. | 电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al |
 .
.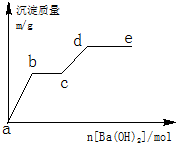 在含有0.4molHCl和0.1molMgSO4的混合溶液中逐滴加入Ba(OH)2 溶液,产生的沉淀质量m与加入Ba(OH)2的物质的量n之间的关系如图所示.
在含有0.4molHCl和0.1molMgSO4的混合溶液中逐滴加入Ba(OH)2 溶液,产生的沉淀质量m与加入Ba(OH)2的物质的量n之间的关系如图所示.