题目内容
5.合成氨反应N2(g)+3H2(g)?2NH3(g),已知H-H键能为436kJ/mol,N≡N键能为945kJ/mol,N-H键能为39IkJ/mol,则该反应的反应热△H为( )| A. | 1471kJ/mol | B. | -1471kJ/mol | C. | 93kJ/mol | D. | -93kJ/mol |
分析 反应热=反应物的总键能-生成物的总键能,据此计算.
解答 解:已知:H-H键能为436kJ/mol,H-N键能为391kJ/mol,令N≡N的键能为945kJ/mol,
对于反应N2(g)+3H2(g)=2NH3(g)△H,
反应热=反应物的总键能-生成物的总键能,故945kJ/mol+3×436kJ/mol-2×3×391kJ/mol=-93kJ/mol
故选D.
点评 本题考查反应热的有关计算,难度中等,掌握反应热与键能的关系是关键.

练习册系列答案
相关题目
15.下列叙述正确的是( )
| A. | 原子半径:Al>Mg>Na>H | B. | 热稳定性:NH3>PH3>H2S>HCl | ||
| C. | 元素非金属性:F>O>N>C | D. | 酸性:HClO4>H2SiO3>H3PO4>H2CO3 |
16.取浓度相同的NaOH和HCl溶液,以2:3体积比相混合,所得溶液的pH等于1,则原溶液的浓度为( )
| A. | 0.01 mol•L-1 | B. | 0.017 mol•L-1 | C. | 0.05 mol•L-1 | D. | 0.50 mol•L-1 |
13.几种短周期元素的原子半径及主要化合价如表( )
下列叙述错误的是(其中NA表示阿伏加德罗常数的值)
| 元素代号 | X | Y | Z | M | N | P |
| 原子半径/nm | 0.186 | 0.143 | 0.075 | 0.074 | 0.152 | 0.099 |
| 元素的主要化合价 | +1 | +3 | +5、-3 | -2 | +1 | +7、-1 |
| A. | X、N元素的金属性:X>N | |
| B. | Y、M元素形成的离子化合物是工业冶炼Y的原料 | |
| C. | X单质在M单质中燃烧生成的化合物39g中共含有0.5NA个阴离子 | |
| D. | 表中Z元素的最高价氧化物的水化物的分子式可表示为H3ZO4 |
10.下列物质性质的比较中,正确的是( )
| A. | 氢化物稳定性:HBr>HCl>PH3 | B. | 离子半径:Na+>Cl->F- | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 离子的还原性 Cl>Br>I |
17.常温下将稀KOH溶液和稀CH3COOH溶液混合,不可能出现的结果是( )
| A. | pH>7,且c(OH?)>c(K+)>c(H+)>c(CH3COO?) | B. | pH>7,且c(K+)+c(H+)=c(CH3COO?)+c(OH?) | ||
| C. | pH<7,且c(CH3COO?)>c(H+)>c(K+)>c(OH?) | D. | pH=7,且c(CH3COO?)=c(K+)>c(H+)=c(OH?) |
14.能源可分为一级能源和二级能源.下列叙述正确的是( )
| A. | 水煤气是一级能源 | B. | 天然气是二级能源 | ||
| C. | 电能是二级能源 | D. | 水力是二级能源 |
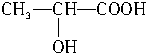
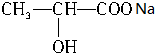 +CO2↑+H2O
+CO2↑+H2O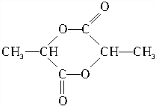 +2H2O.
+2H2O.